
在人们的传统认知中,免疫系统如同驻守各地的卫兵,主要在感染发生的局部“就地作战”。近期,《Microbiome》期刊发表了一项开创性研究,为我们揭示了一幅更为精妙和前瞻的免疫图景:首次系统揭示了脆弱拟杆菌(Bacteroides fragilis, Bf)如何通过持续定植,训练免疫系统产生全身性保护性IgA抗体。这一发现不仅刷新了我们对“肠道-免疫轴”的认知,更可能为未来感染性疾病的预防策略提供全新思路。
一、脆弱拟杆菌:亦友亦敌的肠道“共生者”
在人体肠道微生态中,脆弱拟杆菌是个特殊的存在。这种革兰氏阴性厌氧菌,平时是肠道的“友好邻居”—— 其表面的荚膜多糖 A(PSA)能调节免疫平衡、缓解肠道炎症,帮助维持肠道菌群稳定。
可一旦肠道黏膜屏障因手术、创伤或疾病受损,它就会“趁虚而入”,逃离肠道后成为引发腹腔脓肿、败血症等严重感染的“危险分子”。
这种“共生与致病”的双重属性,让科学家们好奇:免疫系统究竟如何与这类微生物长期共存,还能做到“防患于未然”?
为了解开谜题,研究团队进行了一系列实验。他们发现,仅仅让小鼠单次接触脆弱拟杆菌,只能引发有限的免疫应答。然而,当采用多次口服、模拟稳定定植的方案后,小鼠骨髓中出现了大量能特异性识别脆弱拟杆菌的IgA浆细胞,血液中也检测到高水平的特异性IgA抗体(图1)。
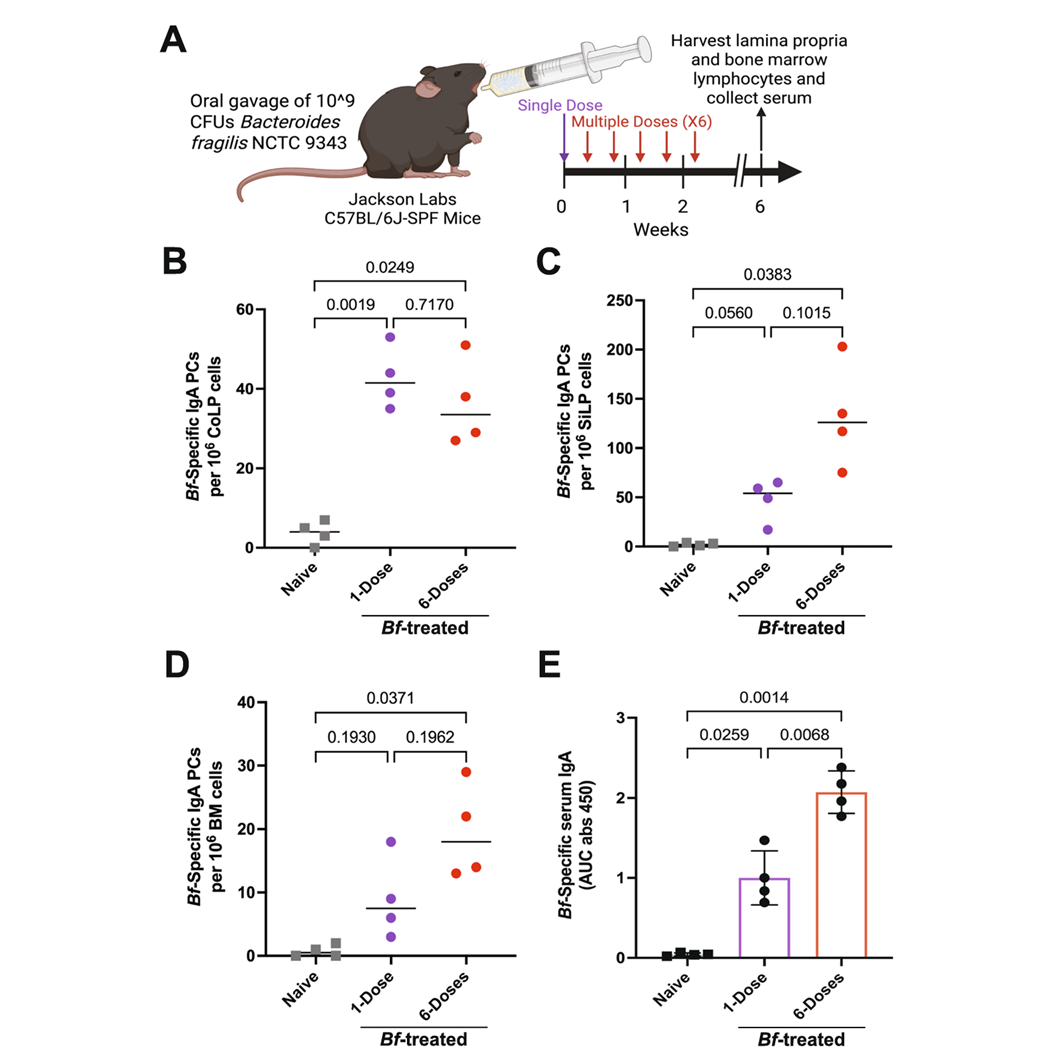
图1:口服脆弱拟杆菌诱导的全身IgA应答
二、免疫 “远程教育” 的关键:派尔结与T细胞的协同作用
这场系统性免疫训练的核心,藏在肠道内的派尔结(Peyer’s patches, PP)中——研究通过盲肠补丁(CP)切除实验排除了盲肠补丁的作用,证实派尔结作为肠道相关淋巴组织的关键组成,能高效捕获、处理脆弱拟杆菌的抗原信息,启动 T 细胞与 B 细胞的协同反应。
研究团队进一步验证:用抗CD40L抗体阻断T-B细胞相互作用后,骨髓、小肠及结肠中的 Bf 特异性 IgA 浆细胞几乎完全消失;而天生缺乏派尔结的小鼠,根本无法启动有效的全身性IgA应答。这意味着,派尔结与T细胞的参与,是脆弱拟杆菌诱导全身免疫防护的“必备条件”(图 2)。
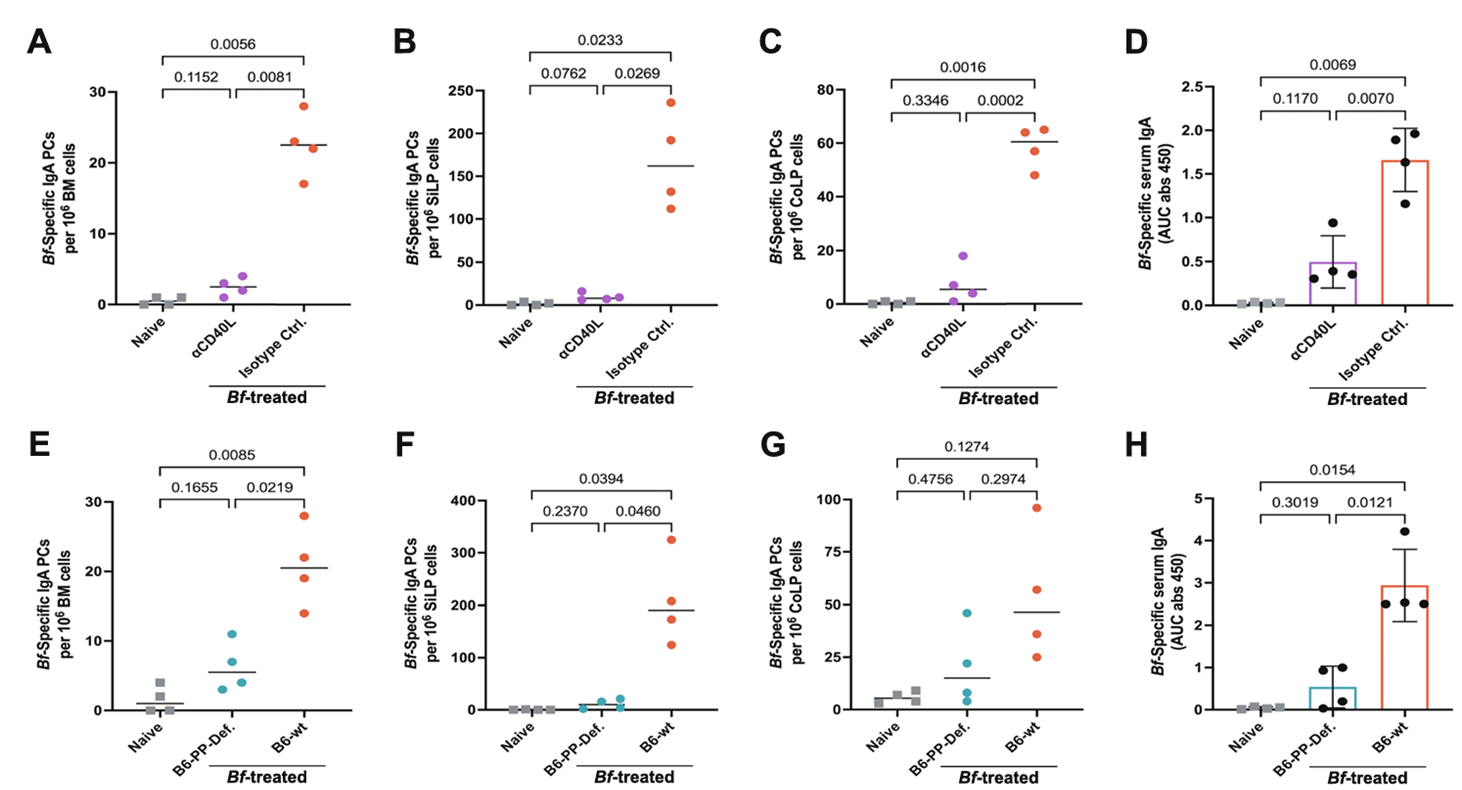
图2:派尔结在Bf特异性IgA生成中的关键作用
三、活菌的持续定植是关键前提
研究还明确了免疫激活的两个核心条件:
必须是活菌:用热灭活的脆弱拟杆菌处理小鼠,无论黏膜还是全身性IgA应答都几乎完全消失,证实活菌是启动免疫反应的“信号源”;
需要持续定植:即便多剂量灌胃建立定植后,用红霉素清除脆弱拟杆菌,先前诱导的IgA应答也会显著下降。
16S rRNA 测序与 qPCR 检测显示,脆弱拟杆菌主要定植于盲肠和结肠,多剂量给药能让其在盲肠的占比显著提升,且不会改变肠道原有菌群组成。
值得注意的是,母鼠垂直传递、共居饲养等自然定植方式,虽能让小鼠粪便中检测到脆弱拟杆菌,却无法诱导显著的全身性 IgA 应答,进一步证实多剂量稳定定植的重要性(图3)。
进一步发现,Bf诱导的全身性IgA应答,不依赖于经典的PSA免疫调节通路,其背后可能存在未被发现的全新机制。
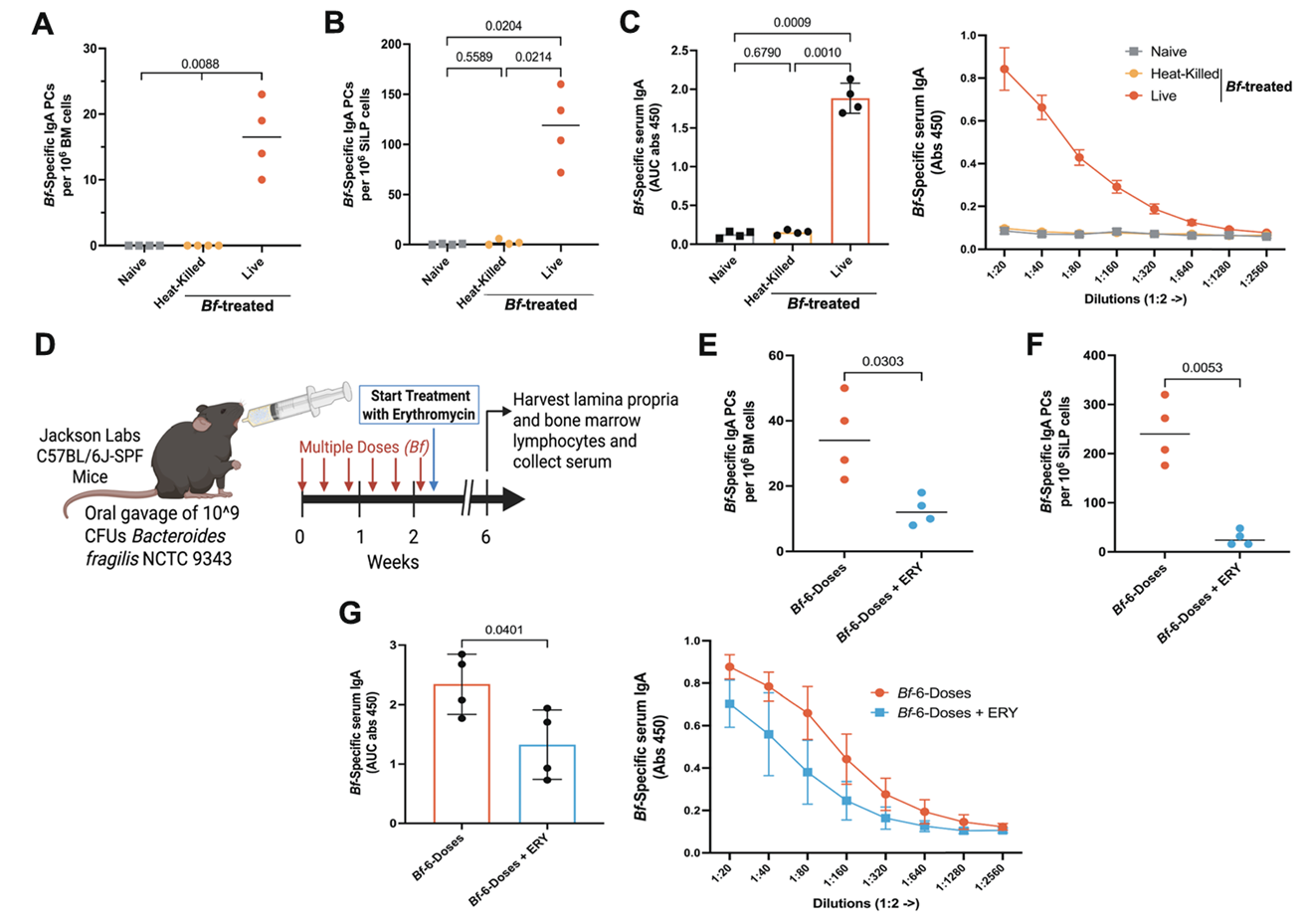
图3:持续活菌定植是系统IgA应答的必要条件
四、远程训练的意义:肠道破损时的 “精准防护”
这场看似 “耗能” 的免疫训练,究竟有何实际意义?研究团队通过肠道穿孔感染模型给出了答案:
预先经多剂量脆弱拟杆菌“训练”的野生型小鼠,腹腔内形成的感染性脓肿数量显著少于未处理小鼠;而IgA基因敲除(IgA⁻/⁻)小鼠,即便体内有高水平的Bf特异性IgG,仍与未处理小鼠一样易感。
更关键的是,派尔结缺陷小鼠经Bf预处理后,脓肿形成数量也显著多于野生型小鼠。这一系列结果证实,派尔结介导的全身性IgA应答,是肠道屏障破损时的 “关键防护网”(图 4)。
这种防护机制的精妙之处在于:肠道屏障完整时,免疫系统通过与脆弱拟杆菌的持续温和接触,提前将特异性IgA“部署” 到全身血液循环中;一旦屏障破损,这些 “储备抗体” 能立即启动非炎症性防护(避免IgG介导的过度炎症损伤),在病原体扩散初期就精准清除,阻止局部感染恶化为致命的全身性疾病。
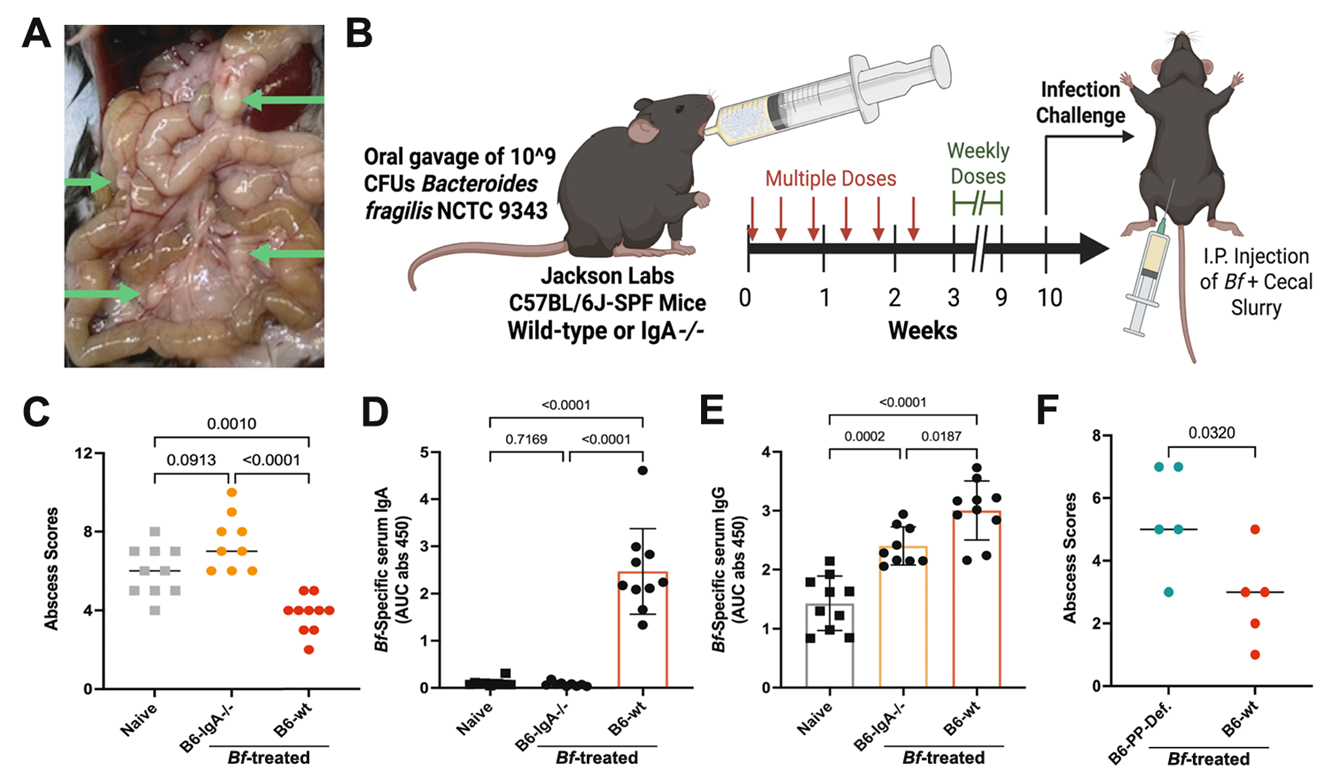
图4:Bf特异性IgA对腹腔脓肿形成的保护作用
五、研究启示:免疫智慧与未来应用方向
这项研究揭示了宿主与微生物共生的精妙进化策略:宿主允许高免疫原性细菌在肠道定植并贴近上皮,同时以系统性IgA应答作为“安全网”—— 屏障完整时享受共生益处,屏障破损时快速控制细菌扩散,实现动态平衡。
这一发现不仅刷新了我们对肠道菌群与免疫系统相互作用的认知,更带来了多重应用启示:
益生菌开发新思路:筛选能高效诱导全身性保护性IgA的菌株,结合多剂量给药方案,有望开发出兼具共生益处与感染防护功能的新一代益生菌;
高风险人群防护:针对腹部手术、肠道屏障损伤高风险患者,可通过靶向微生物干预增强IgA储备,降低术后感染并发症风险;
疫苗设计新方向:深入解析“黏膜免疫到系统免疫”的联动机制,能为黏膜疫苗开发提供新靶点,提升疫苗的全身保护效力。
参考文献
Harris JR, Gubitosi N, Zoccoli-Rodriguez V, et al. Bacteroides fragilis colonization induces protective systemic IgA. Microbiome. 2025;13(1):260.