
TP53突变是人类癌症的重要元凶,它在超过50%的人类癌症中均存在突变,这类肿瘤往往治疗效果差、复发率高。然而,由于其缺乏经典的药物结合位点,TP53长期以来被视为不可成药的靶点。
近年来,T细胞受体工程化T细胞(TCR-T)疗法为靶向此类胞内抗原开辟了新路径。但现有的TP53 TCR-T研究多集中于高加索人群高发的HLA-A*02:01,针对中国及东亚人群流行等位基因(如HLA-A*11:01)的研究仍显匮乏。
2026年1月,上海交通大学医学院附属第一人民医院张岩、宋献民团队联合上海快序生物等团队,在《Journal of Clinical Investigation》期刊上发表重磅研究。上海快序通过独有的从头测序平台成功地鉴定出携带TP53热点突变(TP53R248Q)且具有免疫原性的新抗原肽段。张岩、宋献民领衔的团队针对该肽段开发出高特异性的TCR-T细胞疗法,为东亚人群(尤其是中国患者)中TP53R248Q/HLA-A*11:01阳性肿瘤的治疗提供了全新方案,具备极高的临床转化价值。
TP53R248Q是TP53基因最常见的热点突变之一:在血液系统恶性肿瘤中突变率高达 9.52%,泛癌中位列第二(4.33%),而在我国血液瘤患者中,该突变的检出频率更是达到 6.79%。更关键的是,呈递该突变新抗原的 HLA-A*11:01 等位基因在东亚人群中占比约 42%,仅中国每年就有 4-5 万新诊断患者符合该靶点特征。
此前,针对TP53突变的药物研发屡屡受挫,尚无FDA批准的靶向疗法。而本研究首次在HLA-A*11:01 限制性背景下,验证了TP53R248Q新抗原肽段的免疫原性,成功开发出高特异性TCR-T细胞疗法,不仅填补了该人群的治疗空白,更因精准匹配东亚人群的遗传特征,具备极高的临床转化价值。
二、环状mRNA结合质谱从头测序鉴定真实有效的肿瘤新抗原肽段
要开发高效免疫疗法,首先得找到“真靶点”——肿瘤细胞特有的、能被免疫系统识别的新抗原。传统生物信息学预测方法常面临“假阳性高”的痛点,无法判断预测的新抗原是否在肿瘤细胞表面真实呈递。
本研究通过合成编码TP53的7个热点突变(R175、Y220、R248 等)串联序列的环状mRNA (cmRNA),转染至表达HLA-A*11:01的K562细胞中,结合弱酸洗脱联合质谱(MAE/MS)和从头测序(de novo sequencing)的先进策略,精准鉴定出肿瘤细胞表面由TP53R248Q突变产生的新抗原肽段SCMGGMNQR。这一技术优势彻底避免了“预测存在但实际不呈递”的问题,确保了靶点的真实性与可用性(图1)。
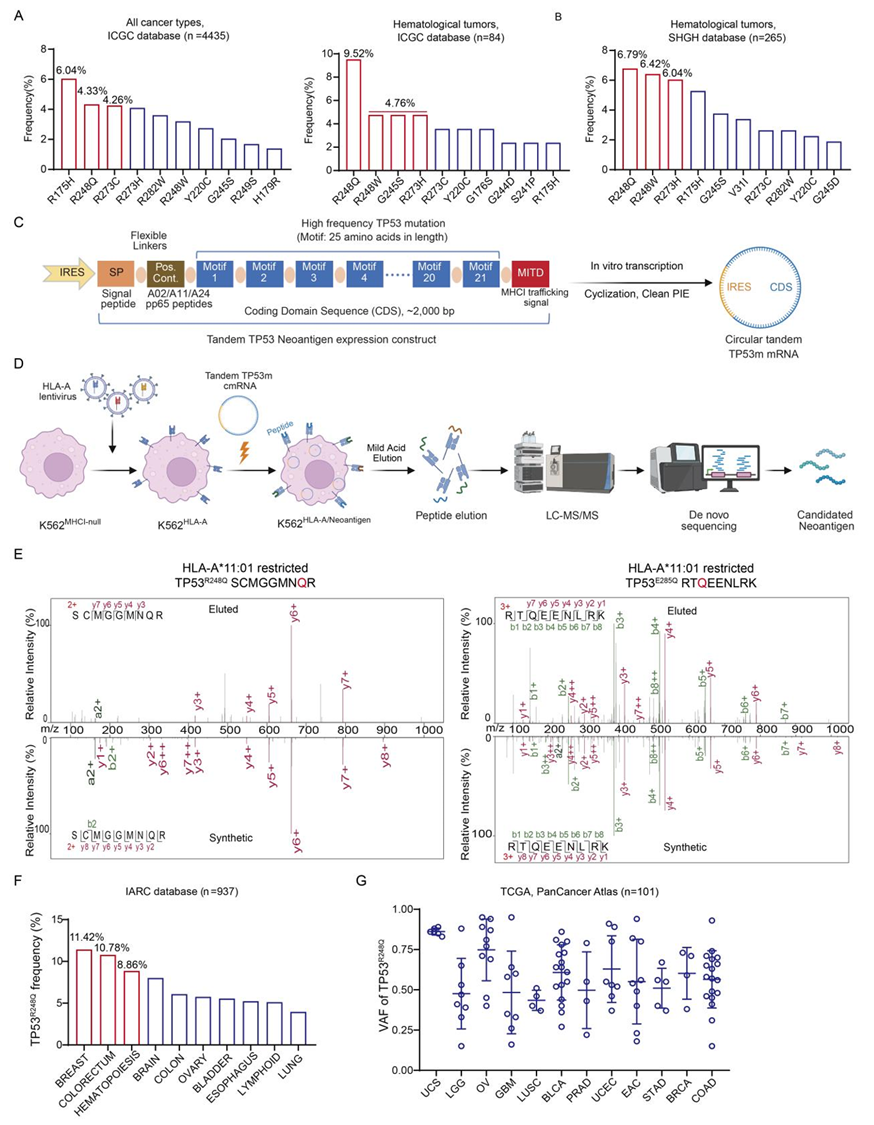
图1 环状mRNA结合质谱从头测序发现TP53热点突变公共新抗原肽段
值得注意的是,该肽段并未被NetMHCpan4.1软件预测为HLA-A*11:01结合肽,但通过质谱从头测序在细胞系及胰腺癌(PDAC)患者组织中均证实了其真实存在(图2)。实验显示,该肽段与HLA-A*11:01的结合半衰期长达10.1小时,远超野生型肽段的1.8小时。这表明依赖软件预测新抗原肽段与HLA的结合并不一定可靠,质谱从头测序可以提供更真实准确的结果。
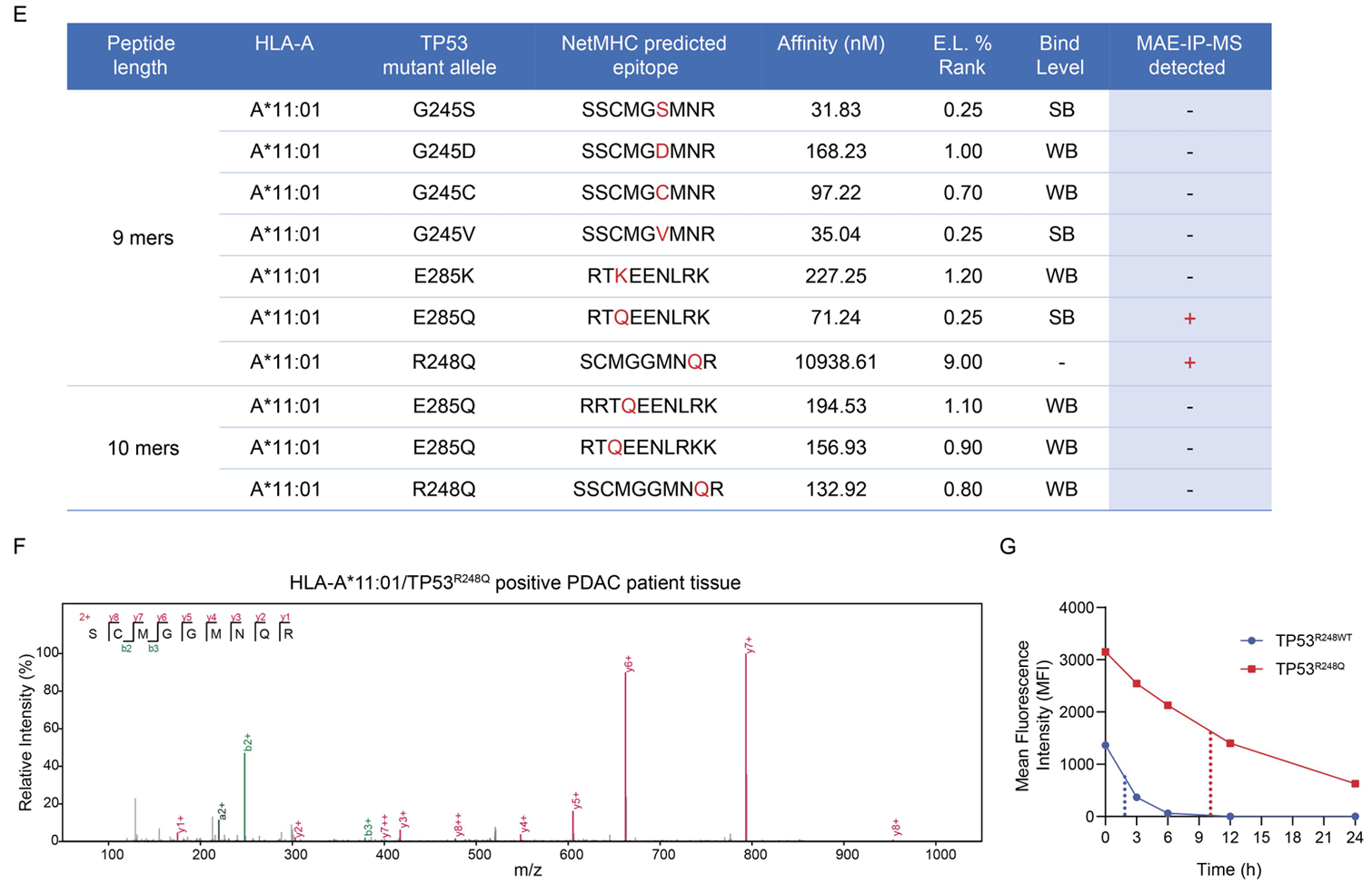
图2 NetMHC4.1对质谱鉴定到的TP53R248Q新抗原肽段结合预测并不准确
三、从健康供体筛选TP53R248Q高亲和特异性TCR
研究团队从HLA-A*11:01阳性健康供者中分离单核细胞,进而诱导为树突状细胞(moDCs)并负载新抗原肽段,与自体naïve CD8+ T细胞共培养3轮后,通过TP53R248Q- HLA-A*11:01 四聚体(Tetramer)分选阳性T细胞,结合单细胞TCR测序筛选出优势TCR克隆(图 3)。进一步的评估中,2号克隆TCR表现出最优效果:严格依赖 TP53R248Q - HLA-A*11:01,不识别TP53野生型或其他R248热点突变,与肽-HLA复合物的结合亲和力为 KD = 1.86 µM。
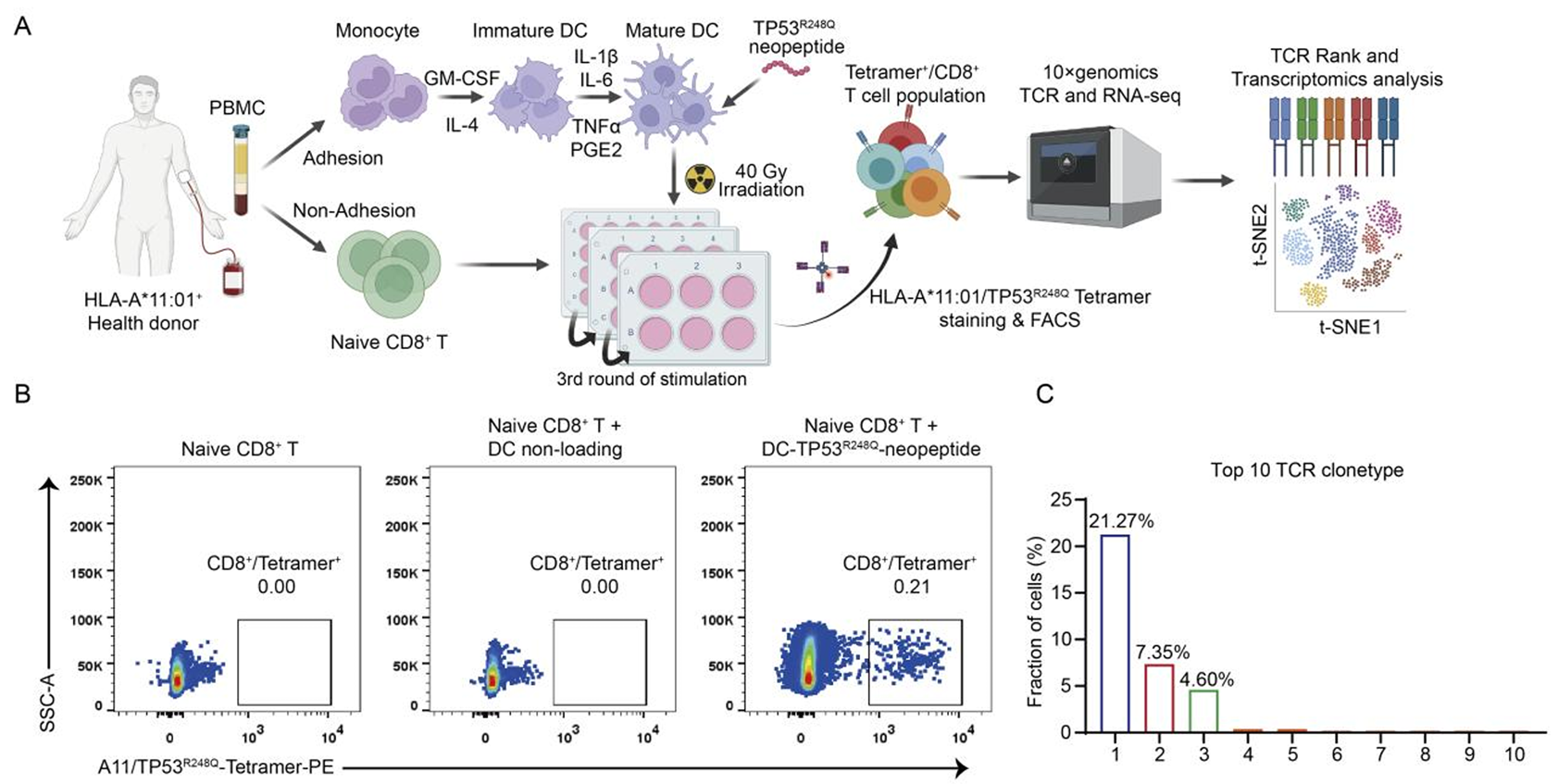
图3 从健康供体筛选HLA-A*11:01-TP53R248Q高特异性TCR
四、HLA-A*11:01-TP53R248Q TCR-T的抗肿瘤效果
研究团队在多个实验维度系统评价了HLA-A*11:01-TP53R248Q TCR-T的广泛抗肿瘤作用:
体外实验:能精准杀伤表达TP53R248Q/HLA-A*11:01的肿瘤细胞系(如NB4, CL40),并有效清除原代白血病患者细胞。
体内药效:在血液瘤 CDX异种移植模型中,TCR-T 组 3/5 小鼠实现肿瘤完全清除,肿瘤负荷近乎清零。在NB4模型中,中位生存期从对照组的20-21天显著延长至28天。
PDX模型验证:在用胰腺癌患者新鲜肿瘤组织构建的胰腺癌PDX模型中,该TCR-T疗法同样观察到显著的抑瘤效应,显著延长了小鼠生存期(图4)。
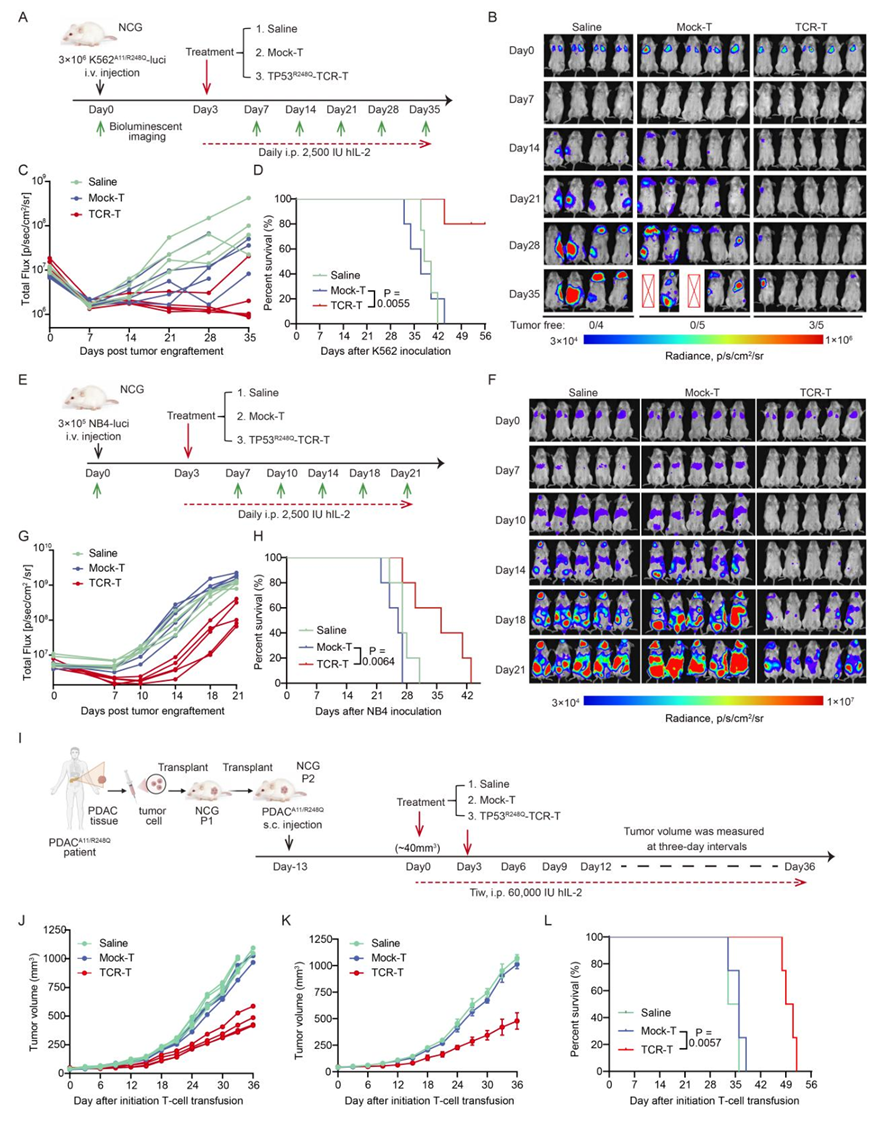
1. 本研究突破传统新抗原鉴定局限,运用环状mRNA联合质谱从头测序策略,成功锁定肿瘤细胞表面HLA-A*11:01真实呈递的TP53R248Q新抗原肽。
2. 该肽段并未被NetMHCpan4.1软件预测为HLA-A*11:01结合肽,但通过质谱从头测序在细胞系及胰腺癌患者组织中均证实了其真实存在,说明质谱+从头测序的策略能够发现新的、真实被细胞或组织呈递的新抗原肽段。
3. 该靶点不仅在血液瘤、实体瘤中广泛高发,更精准匹配东亚人群,填补了适配东亚人群的泛癌种TP53突变免疫治疗靶点空白。
4. 团队以此为核心筛选出的特异性TCR,在多种跨癌种体内外模型中均表现出卓越的抗肿瘤功效,拥有良好的人群普适性与临床转化前景。
5. 本研究构建的技术平台,为其他肿瘤热点突变新抗原的深度挖掘提供了全新思路,也印证了质谱从头测序在新抗原精准鉴定上的独特优势,能够发掘传统技术无法捕捉的关键新抗原肽段。
参考文献
Shen L, Chen Z, Xu J, et al. T cell receptor-engineered T cells targeting the TP53R248Q neoantigen elicit antitumor effects in human cancer models. J Clin Invest. Published online January 13, 2026. doi:10.1172/JCI196613
Rapid Novor 上海快序生物科技有限公司为本项研究提供抗新抗原质谱鉴定分析。
Rapid Novor 快序生物基于质谱和蛋白从头测序技术的Immunovor肿瘤新抗原鉴定利器,可以一网打尽来自基因组、转录组、蛋白组层面所有突变的MHC I/MHCⅡ结合肽段,助力抗肿瘤免疫疗法的高效开发。