
你知道吗?每个人的肠道里都有一个由数百种微生物组成的“微型生态系统”,它们不仅帮助消化食物,还与肥胖、糖尿病甚至炎症肠病等疾病密切相关。然而,长期以来,由于缺乏足够灵敏的检测分析方法,这个“生态系统”中超过80%的低丰度微生物产生的蛋白及其功能,始终像“暗物质”一样隐藏在科学家的视野之外——这就是有待深入探索的肠道“暗宏蛋白质组”(dark metaproteome)。
2025年7月18日,来自维也纳大学、慕尼黑工业大学的研究团队,联合国际知名质谱仪厂商布鲁克(BRUKER)、蛋白从头测序技术全球领跑者快序生物(Rapid Novor)的科学家,在国际顶级期刊Nature Communications上发表了一项突破性研究:他们合作开发的超灵敏宏蛋白质组学技术uMetaP,将肠道“暗宏蛋白质组”的检测灵敏度提升了5000倍,首次揭开了这些低丰度微生物来源蛋白的神秘面纱,并为炎症肠病等疾病的诊断和治疗带来了新希望。
值得一提的是,这是自2024年10月发表多抗测序技术之后,时隔半年Rapid Novor快序生物的研究成果再次亮相Nature Communications,向世界展示了顶级的蛋白从头测序技术Novor,在生物、医药、科研领域的重要价值。
肠道菌群中的“暗物质”:未被看到的关键健康影响因素
肠道菌群是人体最复杂的“共生伙伴”之一。通过基因组学技术,科学家早已发现,每个人的肠道中除了少数高丰度微生物,还有数百种低丰度微生物,它们共同塑造了独一无二的“肠道指纹”。但问题是:由于微生物的功能冗余性,不同微生物可能发挥相同功能。基因组学只能告诉我们“有什么微生物”,却无法明确回答“这些微生物在做什么”。要了解微生物的功能,就需要分析它们产生的蛋白质——这正是宏蛋白质组学的任务。然而,传统质谱技术的灵敏度受限,只能检测到高丰度微生物的蛋白质,超过80%的低丰度微生物的蛋白始终无法被捕捉,形成了“暗宏蛋白质组”。这些“暗物质”可能正是解释个体疾病差异、宿主与微生物互作的关键,却因技术限制一直成谜。
uMetaP的突破,源于对两项核心技术的革新:
一是硬件升级。研究团队将超高效液相色谱(UHPLC)、优化的离子源与极高度灵敏的timsTOF Ultra质谱仪结合,能捕捉到更多微弱的蛋白质信号,鉴定出肽段数量是先前流程的4倍。
二是“从头测序”算法的突破。传统宏蛋白质组学依赖已知数据库匹配蛋白序列,但低丰度微生物蛋白的序列往往不在数据库中。为此,研究团队采用布鲁克PASEF(平行累积连续碎裂)采集的,包括4维数据结构的175万个肽谱匹配(PSMs),训练从头测序算法Novor(Rapid Novor快序生物开发),结合传统数据库搜索开发了novoMP策略:一种从头测序辅助的宏蛋白质组数据库构建方法。
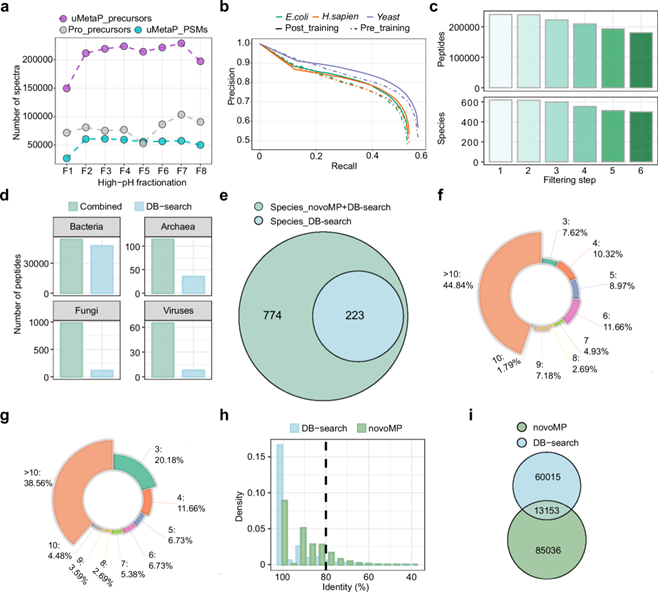
图1 开发novoMP用于宏蛋白质组数据库构建
这一组合让uMetaP的性能实现了质的飞跃:
检测限低至0.0001%,定量限低至0.01%,比先前的质谱方法提升5000倍,并能够识别以前无法检测到的低丰度类群;
通过数据依赖采集(DDA)PASEF模式构建的小鼠粪便宏蛋白质组数据库从223个扩展到774个物种(包括古菌、真菌和病毒),包含20.8万个微生物蛋白序列;
在数据非依赖采集(DIA)PASEF模式下,uMetaP鉴定了210,051个微生物肽段和118,937个蛋白组,是之前技术流程的三到四倍;
小鼠粪便样本中鉴定了1043个未知功能蛋白、2342个小蛋白和581个抗菌肽,这些此前因技术限制未被检测到的蛋白,拓展了对肠道微生物功能的认知。
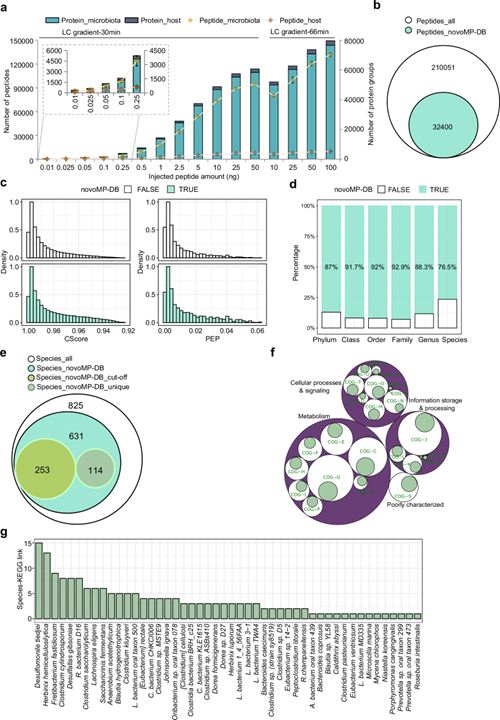
图2 DIA-PASEF uMetaP提升宏蛋白质组检测性能
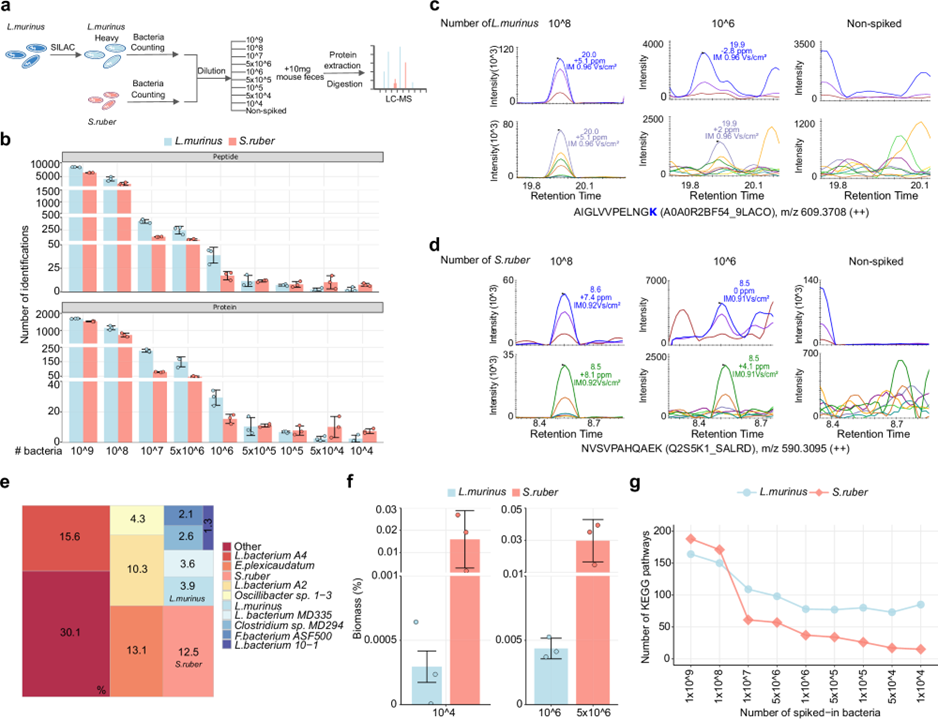
图3 uMetaP重新定义暗宏蛋白质组的检测极限
从小鼠到人类:uMetaP揭示炎症疾病中的“宿主-微生物互作”
为验证uMetaP的价值,研究团队在结肠损伤小鼠模型和克罗恩病(炎症性肠病)患者中展开了研究。结果表明,uMetaP不仅验证了宏基因组学发现的微生物种类变化,更揭示了深层功能关联:发现990种宿主调控蛋白和92个微生物特异性代谢网络,揭示了组织损伤中的新途径。更重要的是,这些发现在人类患者中得到了印证。通过对比204名克罗恩病患者的肠道活检转录组数据,证实了490个蛋白的调控变化,其中包括已知与肠道炎症相关的RELA、NOS2等蛋白。这意味着,uMetaP发现的宿主-微生物互作,很可能是跨物种的保守机制,为理解人类疾病提供了全新视角。
“可药用宏蛋白质组”:uMetaP为炎症肠病找到新疗法
基于这些发现,研究团队首次提出“可药用宏蛋白质组”(druggable metaproteome)概念——即“可被药物靶向的微生物功能蛋白和宿主蛋白枢纽构成的生态网络”,它们可作为药物研发和治疗干预的靶点,为肠道炎症性疾病的治疗提供潜在方向。基于在小鼠和人类中均显著调控的33个蛋白,他们识别出涉及187种药物的204种潜在关联,其中77种是已获批用于人类炎症性疾病相关疾病,包括克罗恩病治疗的药物。更令人兴奋的是,研究还发现了57种获批用于其他疾病的药物,有望被“老药新用”于肠道炎症治疗。
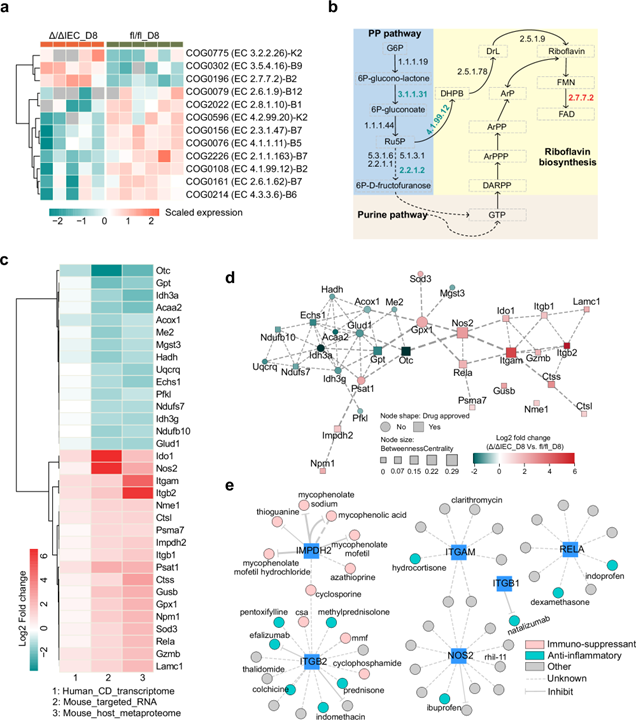
图4 uMetaP揭示炎症性疾病的潜在治疗靶点
uMetaP拓展宏蛋白质组的应用范围和价值
本研究构建的uMetaP技术,不仅能推动肠道菌群研究,还可能应用于海洋、临床微生物检测、单细胞蛋白质组分析等需要超高灵敏度检测的领域——比如早期发现血液中极微量的致病菌蛋白。过去,我们只看到了肠道菌群的“冰山一角”。uMetaP让我们第一次看清了冰山下的世界。随着技术的普及,或许在不久的将来,我们能通过分析“暗宏蛋白质组”,为每个人定制肠道健康方案,让炎症肠病等疾病的精准治疗成为现实。
[1]Xian, F., Brenek, M., Krisp, C.et al. Ultra-sensitive metaproteomics redefines the dark metaproteome, uncovering host-microbiome interactions and drug targets in intestinal diseases. Nat Commun 16, 6644 (2025). https://doi.org/10.1038/s41467-025-61977-7