免疫测定凭借高灵敏度、高特异性及批量检测能力,已成为临床诊断与生物医学研究的核心技术。然而,批间差异(Lot-to-Lot Variance, LTLV)始终是制约其性能的关键瓶颈——不同批次试剂盒对同一样本的检测结果常出现显著偏差,不仅影响科研数据的可重复性,更可能导致临床误诊、误治,直接威胁患者安全。
2023 年丹麦 Nordic Bioscience 科学团队结合 20 年免疫测定开发实践经验,在《Diagnostics》发表综述,系统拆解了LTLV的成因、后果与缓解策略,为行业提供了可落地的解决方案。
一、LTLV 的定义与临床科研风险
LTLV即“不同批次免疫试剂盒检测结果的变异性”,是试剂批间质量一致性不足导致的性能波动。其影响贯穿临床诊断与科研全流程:
临床层面:LTLV可能会引起误诊漏诊,导致患者错失抢救时机,或引发不必要的创伤性治疗。
科研层面:LTLV会破坏实验的可重复性——同一方案换用新批次试剂后,可能无法复现原有数据,导致研究周期延长、资源浪费,甚至影响结论的可靠性。
LTLV的核心影响是削弱免疫测定的“三性”:准确性(结果与真实值的偏差)、精密度(批内/批间结果一致性)与特异性(对目标的识别能力),最终产生结果不确定性。
二、LTLV的核心成因
根据研究经验总结,LTLV的成因可归为三类,其中关键原料质量波动占70%,生产过程偏差占30%,另有少量源于分析物自身的表位不稳定性。
1. 原料质量波动
免疫试剂盒的核心原料多为生物制品,其质量易受制备工艺、储存条件影响,批间一致性难以控制,具体问题集中于以下几类:
抗原
纯度、稳定性不达标是关键。若抗原存在外观浑浊、聚集率高、储存缓冲液不当等问题,会降低标记效率,导致信号减弱、背景升高;合成肽类校准品可能因“截断副产物”,出现总肽含量一致但有效成分批间差异的情况。
抗体
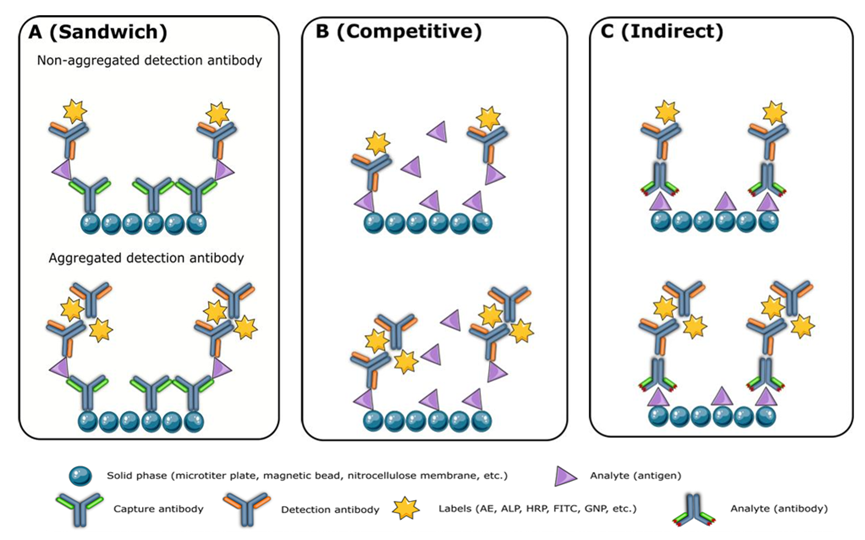
聚集与杂质是主要隐患。高浓度抗体(尤其是IgG3亚型)易形成聚集体,在夹心免疫测定中会导致“信号虚高”,在竞争测定中则导致信号低估(图1)。
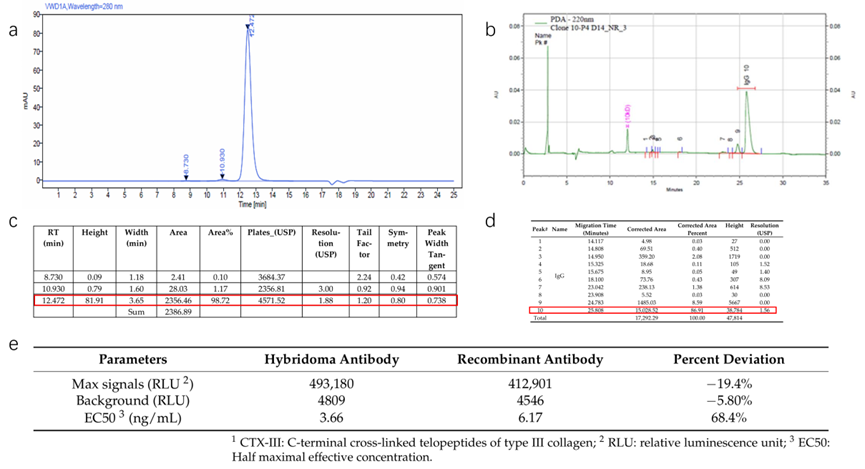
而抗体中的游离轻链、未配对重链(2H1L)等杂质,会直接拉低灵敏度(图2)。例如一个真实的案例:本文研究团队把一个通过杂交瘤生产的CTX-III抗体,转化为重组抗体的过程中,发现重组表达的抗体SEC-HPLC纯度达98.7%,但CE-SDS检测发现有13%杂质(主要包括LC,2H1L,2H,非糖基化IgG),最终导致检测最大信号下降19.4%,EC50(半数有效浓度)升高68.4%。
活性和纯度同样重要。免疫测定中常用的HRP(辣根过氧化物酶)、ALP(碱性磷酸酶),其质量核心是“活性”而非单纯纯度。例如,HRP含7种同工酶,仅同工酶C的催化活性最高(占50%),若某批次同工酶C占比低,即使纯度达90-95%,检测信号仍会显著下降;此外,酶中的未知抑制成分也可能导致批间活性差异。另外,酶标抗体试剂工艺的稳定性,也可能影响性能。例如,该团队测试过某快速HRP标记试剂盒,第一个批次约30%的单克隆抗体未被标记,第二个批次,虽所有抗体均被标记,但产生了过量游离HRP。而使用常规HRP标记试剂盒,获得了单一的标记产物(图3)。
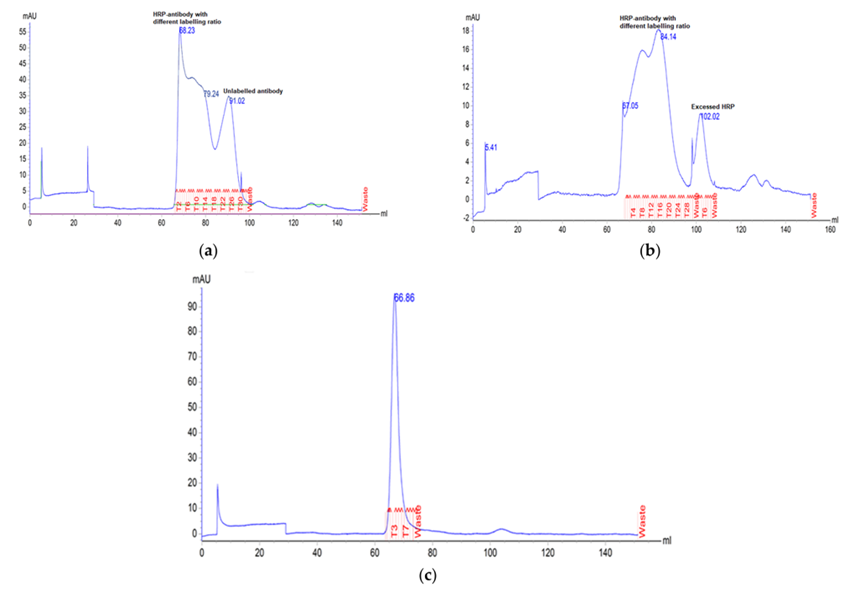
图3 HRP标记试剂盒的稳定性影响产物纯度
其他原料
除此以外,研究使用的质控品与校准品稳定性和一致性也很关键。例如,本研究团队曾发现,某些盒质控品和校准品保质期符合要求,但实测却未达标。另外对于患者混合血清制备的质控品,可能存在稳定性和瓶间均一性的问题。缓冲液的pH、电导率、成分混合均匀度直接影响抗原-抗体结合效率,甚至不同地区超纯水电导率差异(0.05-0.8 µS/cm),也会间接影响免疫测定性能。对于所用容器、微孔板等的质控和适用性,需进行多批次、多样本检测,以获得更可靠的结果。
2. 生产过程中的偏差
体外诊断产品质量受“4P1E”(人员、产品、流程、场所、设备)或 “4M1E”(人员、材料、方法、机器、环境)五大要素影响:
人员与材料
同一操作员不同时间的操作差异(如混合速度、加样量),或关键材料(磁珠、微孔板)更换供应商后未重新验证,均可能引发性能波动。
方法
一个典型的例子是缓冲液的制备,混合过程中,物质的密度、粘度等参数至关重要,另外试剂添加的顺序也必须严格遵循。本文研究团队曾经碰到案例,在制备8升缓冲液时,因化学物质溶解不充分,导致夹心测定背景信号升高40%,部分样本低于定量下限。
设备与场所
环境湿度对硝酸纤维素膜影响显著——湿度>60%时,抗体点样出现“T/C线变宽、拖尾”;湿度<40%时,静电作用导致划线不均、“卫星点”;最佳实践是点样前将设备和膜材在50%湿度环境中平衡数小时。
3. 分析物表位的不稳定性
蛋白酶切割:血液中的 DPP IV、NEP 等蛋白酶会切割分析物的 Pro-Lys、Met-Val 等位点,导致分析物浓度下降并产生批次差异。例如,BNP 会被降解为多种片段,cTnI 的 N/C 端易被水解,且该现象在体外样本中同样存在。
糖基化:约 50% 的蛋白存在糖基化修饰,若修饰位点位于表位区域,会阻碍抗原-抗体结合;部分糖基化分析物缺乏国际标准,商用试剂盒使用非糖基化自制校准品,会引发校准品与临床样品的“互通性问题”;不同人体样本的糖基化模式异质性,也会加剧LTLV。
三、如何减少批间差异(LTLV)?
1. 抗原设计:从源头规避风险
避开易被蛋白酶切割的氨基酸序列(Pro-Lys、Met-Val 等);若切割位点距表位 10-30 个氨基酸,需警惕切割后表位暴露导致的浓度“虚高”。
优先选择无糖基化修饰的表位;若糖基化表位具有临床意义,需表达糖基化抗原用于抗体制备。一些特殊情况,糖基化可阻断酶对切割位点的接触,维持分析物完整性。
2. 原料质控:锁定关键质量属性
抗原和抗体的批间一致性需通过全面质控保障,核心要求包括:
关键属性统一:等电点(pI)、电荷分布、Ig 类别与亚型、稳定性、动力学常数需批间一致。
减少聚集:在缓冲液中添加结构稳定剂(蔗糖、甘油等)或离液剂(盐酸胍、尿素等),通过 SEC-HPLC 去除聚集体。
严格定量与纯度控制:采用UV280+BCA等多种方法定量;CE-SDS 检测纯度,MS和HPLC监测杂蛋白、样本蛋白水解及轻微截短现象;通过SEC-HPLC等技术评估样本均一性,合格原料的单体占比≥95%。
定制储存缓冲液:常规PBS缓冲液未必最佳,对于不同的抗体应定制最适缓冲液。
3. 定向偶联:提升标记一致性
抗原和抗体的随机标记会引入 LTLV,采用位点特异性标记(如抗体糖基化位点结合),可保证批间标记比例和位点一致性,降低变异性。
4. 生产与质控品优化:规范过程 + 精准监测
生产过程标准化:统一缓冲液制备的搅拌速度、时间、温度;实时监测pH、电导率等参数;避免过度混合(防止蛋白剪切损伤);记录至少3批合格产品参数,以均值为工艺参考标准。
质控品(QC)设计升级:添加抑肽酶、AEBSF 等蛋白酶抑制剂,保护BNP、cTnI等易降解分析物;使用与校准品材料/工艺不同的“定制QC品”或“第三方 QC 品”,避免“假阴性”监测结果;冻干以延长保质期。
四、讨论
免疫测定的 LTLV 并非 “不可解”,核心是实现 “从源头到过程的全链条可控”—— 通过抗原设计规避先天风险,通过原料质控建立批间一致性标准,通过生产规范减少过程变异,通过 QC 品优化提升监测有效性。未来,随着参考物质体系的完善与定向偶联、基因工程等技术的发展,LTLV 的影响将进一步降低,推动免疫测定向 “更高精度、更稳定” 迈进,为临床诊断和生物医学研究提供更可靠的支撑。
参考文献
[1] Luo Y, Pehrsson M, Langholm L, Karsdal M, Bay-Jensen AC, Sun S. Lot-to-Lot Variance in Immunoassays-Causes, Consequences, and Solutions. Diagnostics (Basel). 2023;13(11):1835. Published 2023 May 24. doi:10.3390/diagnostics13111835