前言
这篇文章重新定义了抗体可变区(V区)与恒定区(C区)的关联:二者并非独立发挥作用,而是通过结构互作共同决定抗体的抗原识别能力与效应功能,提示研究中需将二者视为不可分割的整体,每一个位点对抗体功能都至关重要。
一方面对于抗体的工程改造研究,除了关心V区序列,还需考虑V区与C区的适配,基于蛋白从头测序的抗体测序技术,可以快速获得任何形式抗体的全长序列,包括恒定区,为解析V-C适配机制、指导工程改造提供了关键的序列基础。
另一方面对于新抗体的发现研究,传统仅测定V区序列、忽视C区信息的方法存在明显局限。文章明确指出,C区不仅参与调控V区抗原识别,其亚型选择还与抗体效应功能及疾病防御效果直接相关。Rapid Novor 快序生物基于血清多抗的抗体开发技术,可以快速从免疫后人和动物的分泌型抗体库中测到天然抗体,获得全长序列和修饰信息,这一技术路径与文章强调的“抗体整体观”高度契合,能为新抗体发现提供更全面的功能参考。
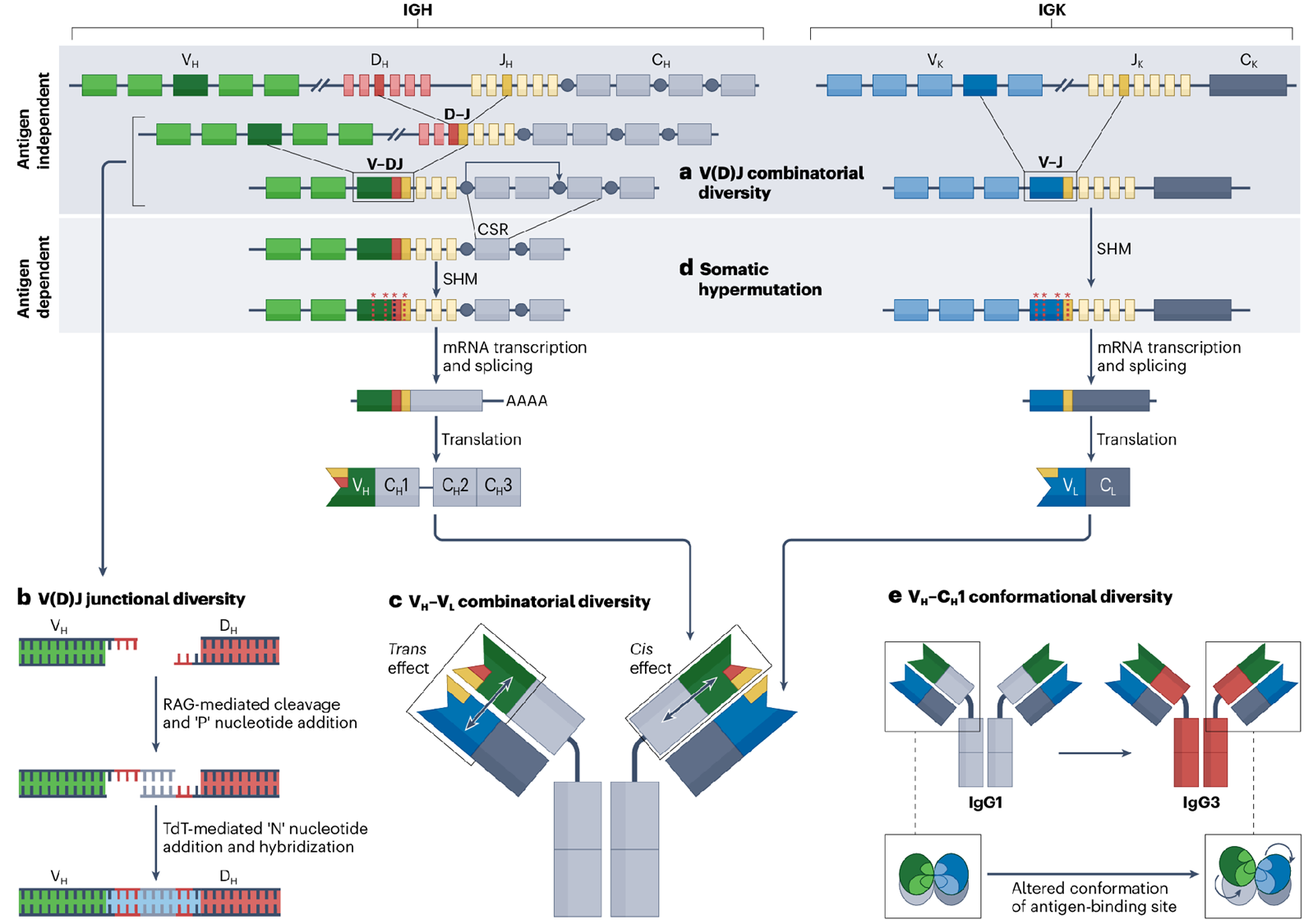
图1 抗体多样性的产生机制
但随着研究深入,科学家发现了越来越多这个模型解释不了的现象:
例如针对某些抗原的抗体反应异常“专一”:只使用少数几种V区基因,甚至只选择特定亚型(如IgG2、IgG3),这就是“抗体限制性”。
这种例子并不罕见:
小鼠抗肺炎球菌磷酸胆碱的抗体,几乎全依赖“T15独特型”V区基因;
小鼠抗隐球菌多糖的抗体,偏好使用VH7183、Vκ5.1等少数V区片段;
新冠康复者体内,抗SARS-CoV-2刺突蛋白的抗体,常集中使用IGHV3-30、IGKV1-39等“热门”V区基因。
同样的,亚型选择也存在限制:人类抗肺炎球菌多糖的抗体以IgG2为主。小鼠抗炭疽毒素的抗体主要为IgG1,但实验显示,换成其他亚型(如IgG2a)的抗体反而保护力更强。
这些“异常发现”指向一个结论:抗体的可变区和恒定区,一定存在某种我们没发现的联系。
抗体结构的秘密:C区如何影响V区与抗原的结合?
要理解这一关联,需要从一个概念出发:抗体的构象灵活性。
抗体不是“僵硬的结构”,而是像“灵活的机械臂”——比如Fab段(抗体的抗原结合部分,由V区和C区的CH1/CL组成)有个“肘部角度”(V区与C区的夹角),这个角度的大小会直接影响V区抗原结合位点的形状(图2),而这一角度,恰恰是由C区调控:
轻链类型影响灵活性:人和小鼠λ轻链的C区N端比κ多一个甘氨酸,导致Fab段的“肘部角度”变化更大,能结合更多样的抗原;
更关键的是CH1区(重链C区的第一个结构域):它通过3个关键loops(BC、DE、FG)与V区(VH)直接接触,固定VH的构象。如果CH1的序列变了(比如同种型转换时,从IgM换成IgG1的CH1),VH的构象就会跟着变,进而影响抗原结合。
实验证据证实:如果把抗体的CH1区删掉,V区会变得“过度灵活”,不仅可能结合抗原的亲和力下降,还可能出现“多反应性”(比如同时结合自身蛋白,增加自身免疫风险)。而不同亚型的CH1序列差异会导致这种“稳定作用”的强度不同——这也解释了为什么抗体亚型转换不仅改变效应功能,还可能改变抗原结合特异性。
更颠覆认知的是,抗原结合不仅改变Fab区构象,还可能通过VH-CH1的构象变化,让FC区处于“高亲和力状态”,让单个抗体也能高效结合FC受体。这为解释“单抗如何中和毒素”提供了新视角。
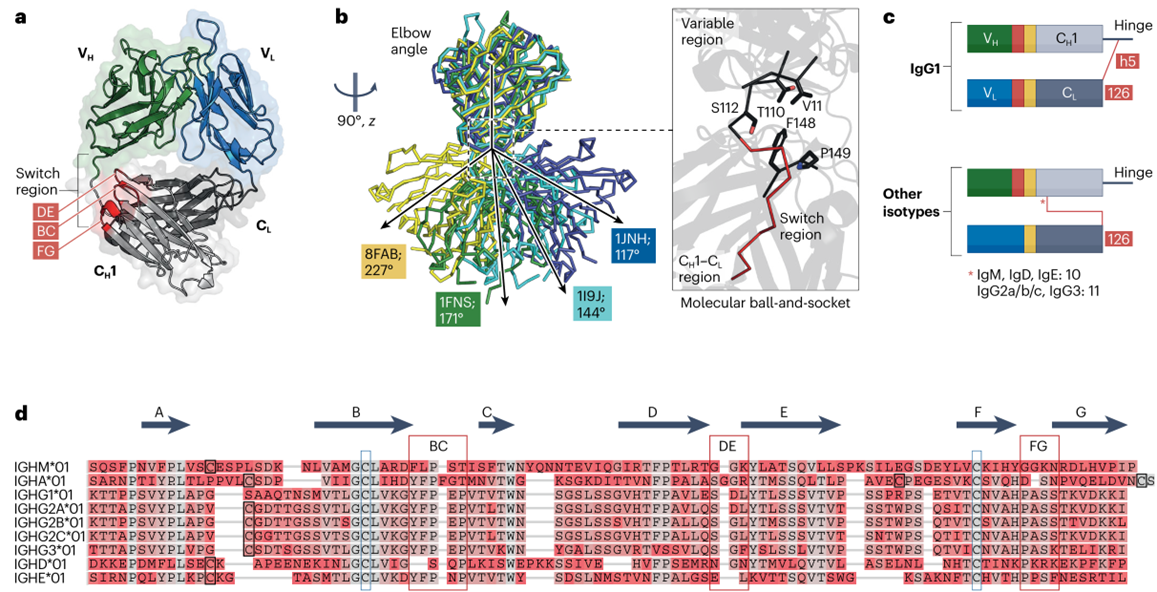
图2 CH1对Fab整体构象的影响
抗体限制性的新答案:既要“精准识别”,更要“避免自伤”
现在,我们终于能解释那个困扰免疫学家几十年的问题:为什么抗体应答会存在“限制性表达”?
传统的一些解释,比如“这些V区是“最优解”、或者“为了避免自身免疫”,都能发现一些反例。而新模型给出了更合理的答案:免疫系统选择的不是“单独的V区”,而是“V区-CH1区的最佳配对”——既要保证能结合病原体,又要避免结合自身蛋白(图3)。
具体来说:
V区的“先天偏好”:种系V区基因并非随机进化,而是保留了对“高危病原体抗原表位”的先天特异性(如抗细菌多糖的V区)。这些V区与特定CH1组合时,能形成“高保真”的抗体互作位,减少误结合自身的风险。
CH1的“筛选作用”:亚型转换时,CH1序列改变会调整VH构象。如果新的“V区-CH1组合”导致抗体互补位变形(要么不结合抗原,要么结合自身),这类B细胞会被负选择清除——这也解释了为什么某些亚型(如IgG3)在自然免疫反应中占比低,却可能在体外实验中更有效(避开了体内的负选择压力)。
免疫发育的“妥协”:IgM作为最早产生的抗体,CH1对V区的限制较宽松,因此IgM常表现出“多反应性”(能结合多种抗原),这是机体应对早期感染的“应急策略”;而后续的IgG等亚型,CH1限制更严格,特异性更高,同时避免自身免疫。
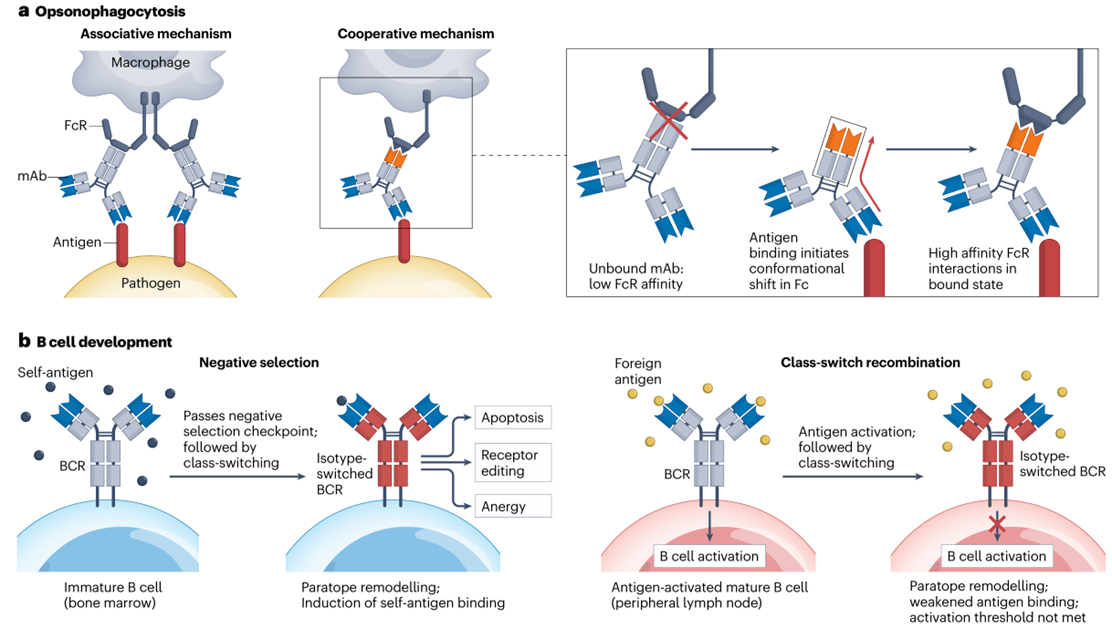
图3 抗体可变区与恒定区间的变构效应在抗原结合及类别转换中的功能意义
新发现如何改变抗体药研发?
这些发现不仅深化了抗体基础认知,更给抗体药物设计带来了“反传统”的指导思路——不能再只盯着V区优化,C区的选择和改造同样关键(表1):
避免脱靶:如果选择的C区会导致V区构象不稳定,可能引发多反应性,增加自身免疫风险;
关注CH1-V区适配性:选择抗体亚型时,不能只比较Fc介导的效应(如ADCC、CDC),还要评估CH1与V区的“适配性”。
推动精准设计:未来可能会根据靶点抗原的结构,“定制”CH1-V区的配对,可通过改造CH1的关键loop,优化V区的抗原互补位构象。

表1 影响抗体亲和力和特异性的因素
总结
这篇综述最核心的价值,是打破了抗体“模块化分工”的传统认知,让我们看到:抗体是一个动态的“协同系统”——V区和C区通过构象对话,共同实现“精准识别抗原+避免自身损伤”的平衡。对免疫学家而言,这为理解自身免疫病(如红斑狼疮中“自反应抗体的产生”)提供了新方向;对药物研发者而言,这打开了“从C区优化抗体”的新赛道。未来,结合冷冻电镜、分子动力学模拟等技术,我们或许能更精细地“调控”V区-C区的互动,开发出更安全、更有效的抗体药物。
参考文献
[1] McConnell, S. A., & Casadevall, A. (2025). New insights into antibody structure with implications for specificity, variable region restriction and isotype choice. Nature reviews. Immunology, 25(8), 621–632. https://doi.org/10.1038/s41577-025-01150-9