
摘要:
T细胞恶性肿瘤是源于T淋巴细胞的恶性疾病,现有的疗法常面临复发和脱靶毒性等问题。因此,开发既有效又安全的免疫疗法对于T细胞恶性肿瘤的治疗具有重要的临床价值。尽管已有报道称嵌合抗原受体(CAR)T细胞疗法取得了一定成效,但其可能导致健康T细胞的耗竭,从而加剧患者免疫力下降引发感染的风险。本文研究团队开发了一种新策略,旨在不损害健康T细胞的同时,精准治疗T细胞恶性肿瘤(图1)。
首先,研究团队对T细胞淋巴瘤患者的T细胞受体(TCR)进行了深入分析,发现恶性细胞常表达一种特定的T细胞受体β链可变区(TRBV)克隆TRBV20-1(Vβ2)。基于此发现,研究团队提出假设:开发靶向这些恶性肿瘤中主要的TRBV的免疫疗法,可以实现对肿瘤T细胞的精准治疗。
为了验证此假设,研究团队利用快序生物(Rapid Novor)的蛋白从头测序技术(REmAb),成功解析了一种鼠源Vβ2抗体(MPB2D5)的全长氨基酸序列。随后,通过工程化改造,设计了CAR构建体(CAR-Vβ2)并进行了人源化处理。这种工程化T细胞在体内外实验中均展示出对Vβ2+恶性T细胞的特异性清除能力。
此外,研究团队还开发了一种基于抗体依赖性细胞毒性(ADCC)的自然杀伤(NK)细胞疗法。研究团队通过在Vβ2抗体中引入Fc突变并对生产抗体的细胞系进行改造,获得了具有增强的ADCC活性的去岩藻糖基化抗体,为T细胞恶性肿瘤的治疗又提供了一个有力工具。
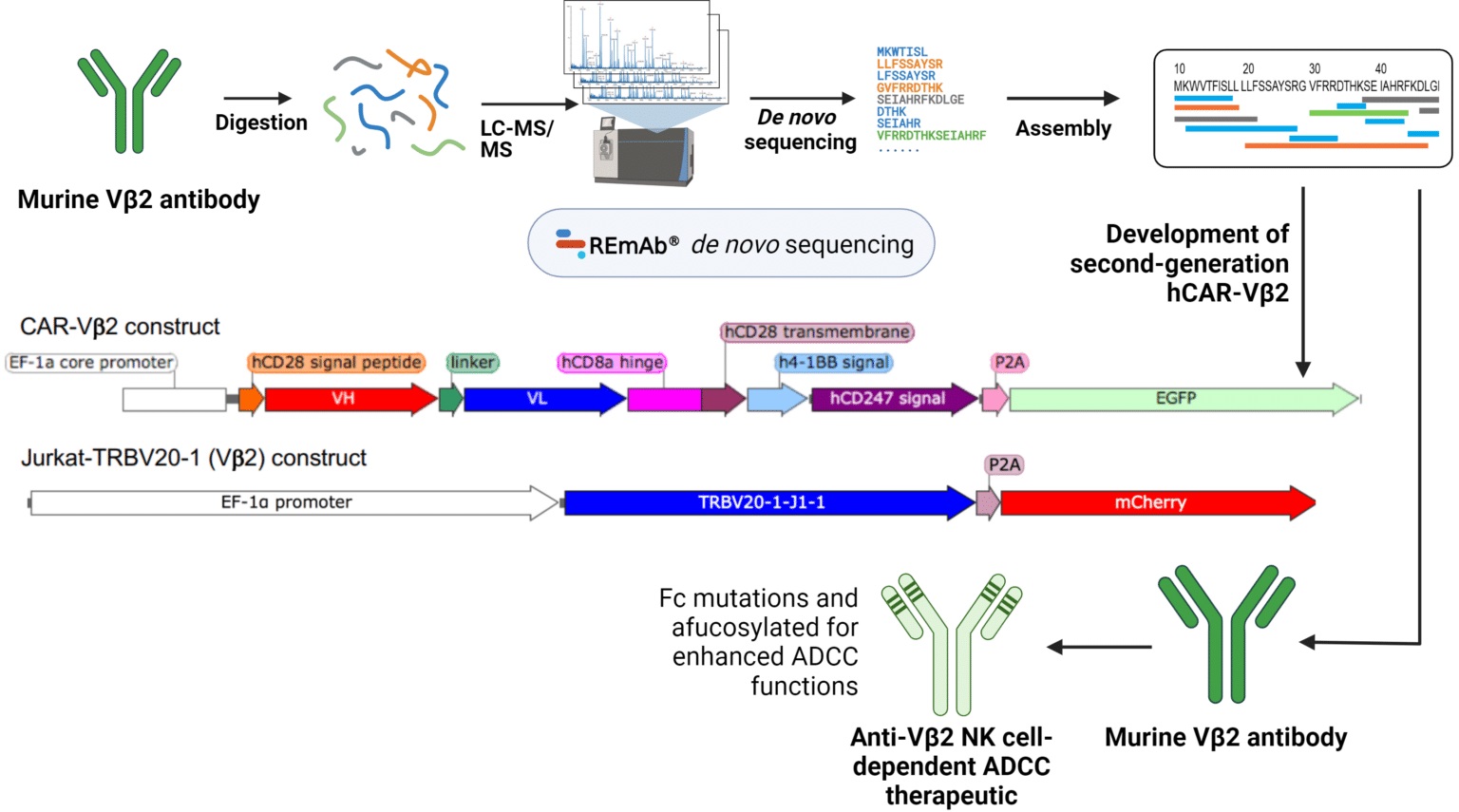
图1 基于蛋白从头测序技术的T细胞瘤免疫疗法开发流程
结果
构建靶向恶性T细胞上TCR Vβ2+的CAR-T细胞
研究团队首先使用一系列Vβ特异性抗体分析了72名患者的皮肤T细胞淋巴瘤(CTCL)细胞中的TRBV,发现其中Vβ2(TRBV20-1)最为常见(图2 a)。通过流式细胞术和单细胞测序分析一名Vβ2+Sézary综合征(SS)患者的细胞,也证实了这一结论(图2 b)。这些结果提示,靶向Vβ2的免疫疗法可能治疗CTCL,同时最大限度维持患者正常的免疫功能。为了构建靶向治疗策略,研究团队利用快序生物(Rapid Novor)的蛋白从头测序技术(REmAb)获得了Vβ2抗体的准确全长氨基酸序列,并进行改造,用于CAR-T的构建(mCAR-Vβ2)。起初,团队尝试使用患者的自身T细胞构建CAR-T,但其转染效率和CAR表达水平都低于健康供体T细胞,且对Vβ2+CTCL细胞的杀伤作用也较弱。因此,团队转向探索利用健康供体T细胞获得现货型同种异体mCAR-Vβ2 T细胞,用于CLTL治疗的可行性。为了减少CAR-T治疗可能引起的移植物抗宿主反应(GVH),研究团队敲除了健康供体T细胞上的TRAC/B2M/CIITA基因,构建了mCAR-Vβ2 T细胞。这种三重基因敲除的工程化T细胞可以在高效杀伤Vβ2+CTCL细胞的同时,不杀伤正常细胞(图2 c-f)。
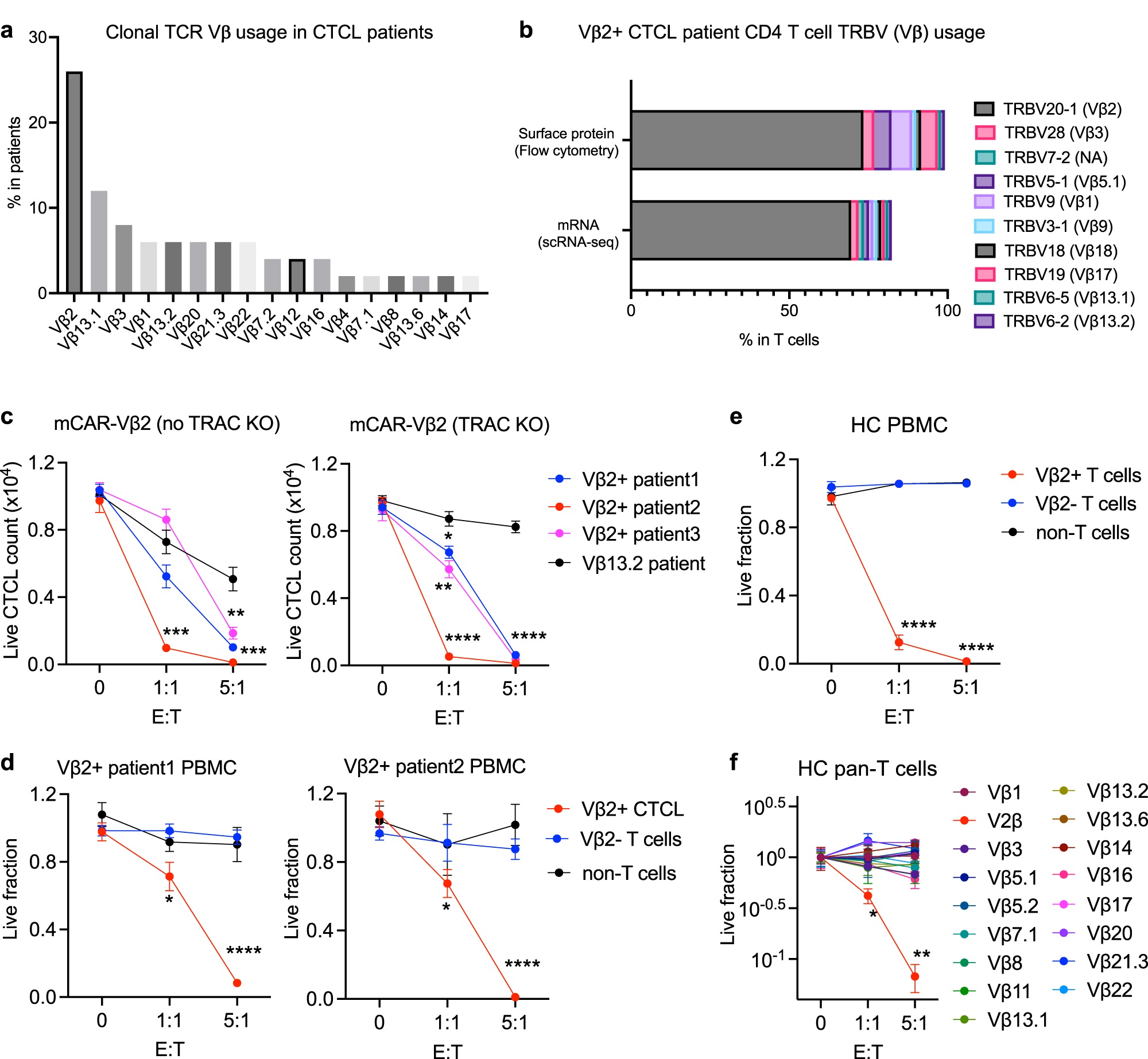
图2 构建靶向TCR-Vβ2的mCAR-T细胞
同种异体的mCAR-Vβ2 T细胞可以发挥高效特异的体内抗肿瘤作用
接下来,研究团队构建了Vβ2+外周T细胞淋巴瘤(PTCL)的人源性肿瘤异种移植(PDX)小鼠模型来评价mCAR-Vβ2 T细胞的体内抗肿瘤效果(图3 a)。mCAR-Vβ2 T细胞治疗后,在小鼠的骨髓、脾脏和外周血中均显著杀伤Vβ2+ PTCL细胞,而不影响Vβ2-正常细胞的存活(图3b-i)。
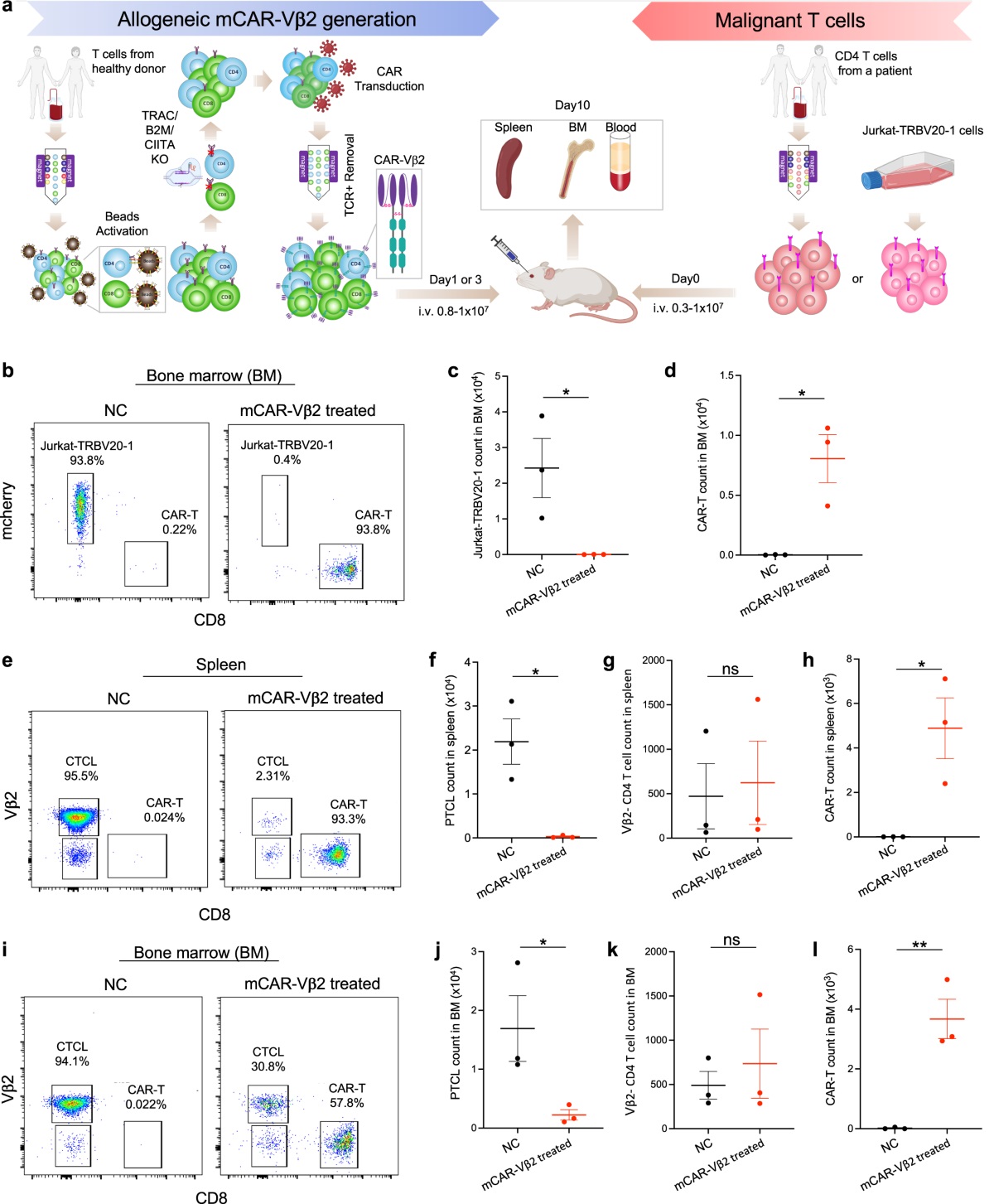
图3 同种异体mCAR-T细胞的体内抗肿瘤作用
CAR-Vβ2 T细胞的人源化改造
为了拓展mCAR-Vβ2 T细胞的临床应用前景,研究团队对其进行了进一步的人源化改造,共获得24个候选分子。其中最优的分子hCAR-Vβ2被用于后续的体内抗肿瘤作用研究。hCAR-Vβ2在Vβ2+ CTCL PDX小鼠模型上表现出了良好的抗肿瘤作用和安全性,表明这种人源化策略成功保留了mCAR-Vβ2 T细胞的肿瘤细胞特异性靶向识别和杀伤效率,同时大幅降低了其免疫原性,为临床应用提供了良好的基础。
CRISPR-AAV系统用于CAR-Vβ2工程化改造
上述研究中使用慢病毒系统递送CAR,存在基因组随机整合的风险。因此为了减少CAR-T疗法在临床应用中的潜在安全隐患,进一步拓展其临床应用价值,研究团队构建了CRISPR-AAV系统用于CAR的递送和精准整合(图4 a)。结果表明,CRISPR-AAV构建的hCAR-Vβ2 T细胞在患者恶性T细胞的体内外模型中均表现出对Vβ2+恶性T细胞的特异性杀伤作用(图4b-k)。由于患者原发的恶性T细胞在小鼠体内无法长期存活,研究团队又使用一种稳定表达荧光素酶的Jurkat-TRBV20-1细胞建立长期的PDX小鼠肿瘤模型。结果表明,无论是慢病毒还是CRISPR-AAV系统构建的hCAR-Vβ2 T细胞,在长达30天的时间内都可显著抑制肿瘤的生长,延长小鼠的生存率,且不会导致小鼠体重减轻,表现出了良好的安全性(图4 n-q)。
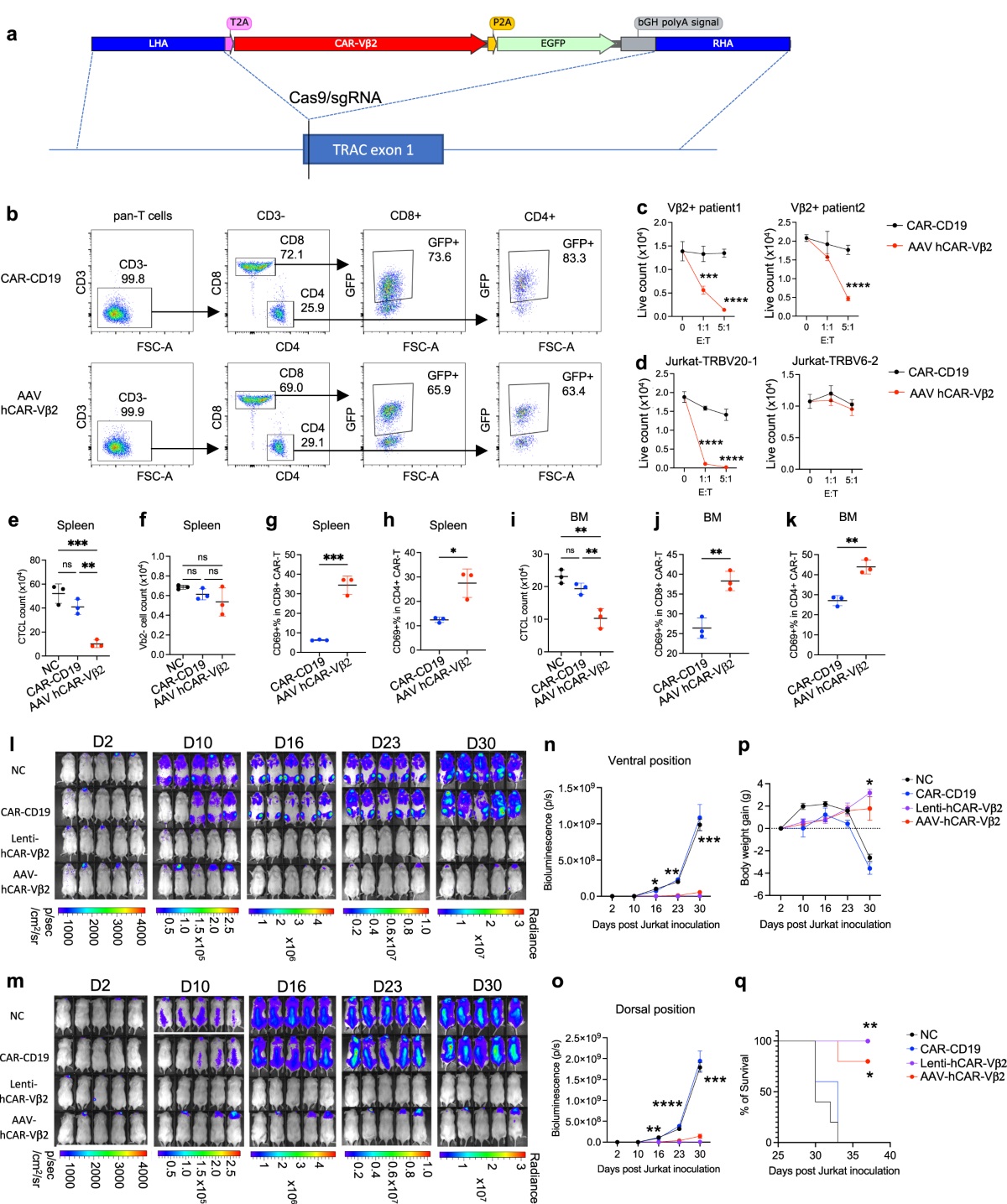
图4 CRISPR-AAV系统构建CAR-Vβ2 T细胞的抗肿瘤作用
筛选用于同种异体hCAR-Vβ2 T细胞扩增分化的细胞因子组合
为了筛选体外构建hCAR-Vβ2 T细胞的细胞培养条件,研究团队探索了20种细胞因子组合对CAR-T构建和功能的影响。其中IL7、IL15和IL12的组合可以同时促进CAR-T的扩增、分化,维持它的杀伤能力。
增强ADCC功能的人源化Vβ2抗体用于Vβ2+T细胞恶性肿瘤治疗
由于不同临床阶段的患者需要不同的治疗方法,例如某些类型和阶段的TCL患者更适合治疗性抗体,而不是CAR-T疗法。因此团队开发了一种基于人源化Vβ2抗体和异体NK细胞的ADCC平台。研究团队首先在人源化Vβ2 IgG1抗体(h-anti-Vβ2)的Fc区引入突变,接着在生产抗体的细胞系中敲除Fut8基因用来消除抗体的岩藻糖基化翻译后修饰,从而增强了其ADCC的活性。体外实验表明,优化后的h-anti-Vβ2 IgG1抗体表现出良好的NK细胞介导的ADCC杀伤Vβ2+ CTCL细胞的作用,且同时不杀伤正常细胞。这种方法可以作为CAR-T细胞疗法的补充,更好地满足临床需求。
关键点
l 研究团队开发了一种靶向T细胞恶性肿瘤特有TCR克隆的疗法,实现了精准杀伤肿瘤细胞的同时,不杀伤其他正常细胞。
l 借助快序生物(Rapid Novor)的REmAb蛋白从头测序技术,研究团队获得了Vβ2 抗体的全长精准氨基酸序列,并将其用于CAR-T和ADCC疗法的开发。
l 人源化的CAR-Vβ2 T细胞在体内外均表现出对Vβ2+恶性T细胞的特异性清除作用,展现出良好的临床应用前景。
参考资料
1. Ren J, Liao X, Lewis JM, Chang J, Qu R, Carlson KR, Foss F, Girardi M. Generation and optimization of off-the-shelf immunotherapeutics targeting TCR-Vβ2+ T cell malignancy. Nat Commun. 2024 Jan 15;15(1):519. doi: 10.1038/s41467-024-44786-2.
2. https://www.rapidnovor.com/immunotherapeutics-targeting-tcell-malignancy/