
快序荐文:
(1) 随着人们对自身抗体的认知不断深入,越来越多的精神类疾病被发现与自免机制密切相关,因此深入解析这些自身抗体的结构功能特征,对疾病机制的基础研究,和新型疗法的开发都具有重要意义。
(2) 本文揭示了CASPR2蛋白的自身抗体与神经性疼痛的密切关联。有趣的是,不同的IgG亚型的功能不同,IgG4亚型因其结构功能特征,产生了独特的致病作用。
(3) Rapid Novor快序生物全球唯一的多抗测序技术,可以直接解析血清中天然多抗蛋白的氨基酸序列,助力自身抗体研究。
简介
在神经疾病的世界里,有一种疼痛格外顽固——神经性疼痛。它不像普通疼痛那样因外伤而起,而是源于神经系统本身的“异常兴奋”。最近的一项研究,为我们揭开了这类疼痛背后的关键机制——一种针对CASPR2蛋白的自身抗体,尤其是IgG4亚型,竟能让背根神经节(DRG)神经元“过度兴奋”,从而引发剧烈的神经性疼痛。
当免疫系统“认错人”:CASPR2抗体的致病性
CASPR2蛋白属于神经连接蛋白家族,是背根神经节(DRG)神经元中电压门控钾通道复合体(VGKC)的重要组成部分,在正常生理状态下,负责维持神经元的电活动稳定。
但在某些患者体内,免疫系统却错误识别了CASPR2,产生了针对性的自身抗体(aAbs)。这些抗体结合到CASPR2上,引发一系列病理反应。CASPR2抗体相关疾病会导致边缘系统脑炎、纤颤性舞蹈病等疾病,部分患者会出现严重的神经性疼痛。然而,CASPR2自身抗体引发神经病理性疼痛的机制仍不明确。
IgG4 CASPR2抗体或是疼痛的“元凶”
研究团队分析了49份CASPR2抗体阳性的患者血清,包括他们的抗体亚型和患者是否出现疼痛症状。研究发现一个关键细节:这些抗体主要属于CASPR2 IgG4亚类,但部分患者还同时存在IgG1-3亚类(图1)。
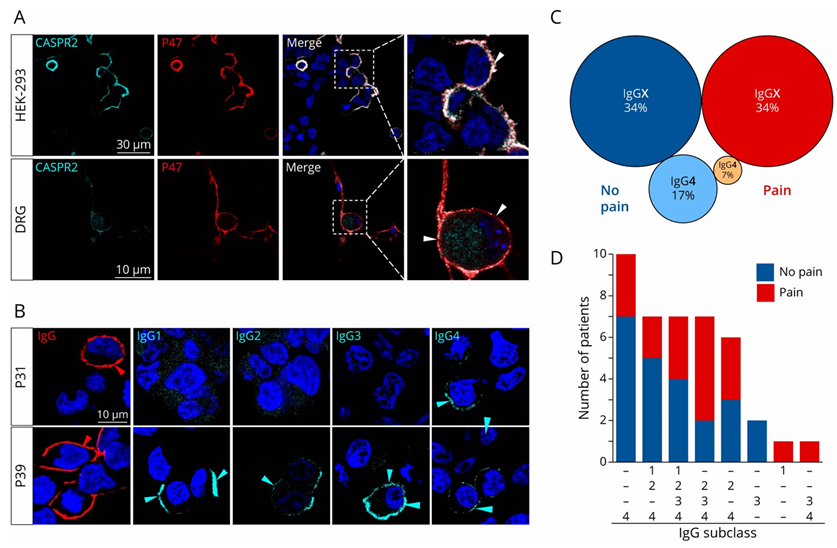
图1·患者血清中的CASPR2自身抗体呈现不同的IgG亚类组成
通过超分辨率显微镜、钙成像和电生理记录等技术,研究人员发现:
CASPR2抗体破坏VGKC复合体结构
在正常情况下,CASPR2与钾通道紧密结合,共同调控钾离子外流,使神经元保持“冷静”。但当IgG4抗体结合到CASPR2上后,CASPR2与钾通道之间的距离被拉大,就像电路中的导线被强行分开,VGKC复合体的结构完整性被破坏,导致钾通道功能受损(图2)。
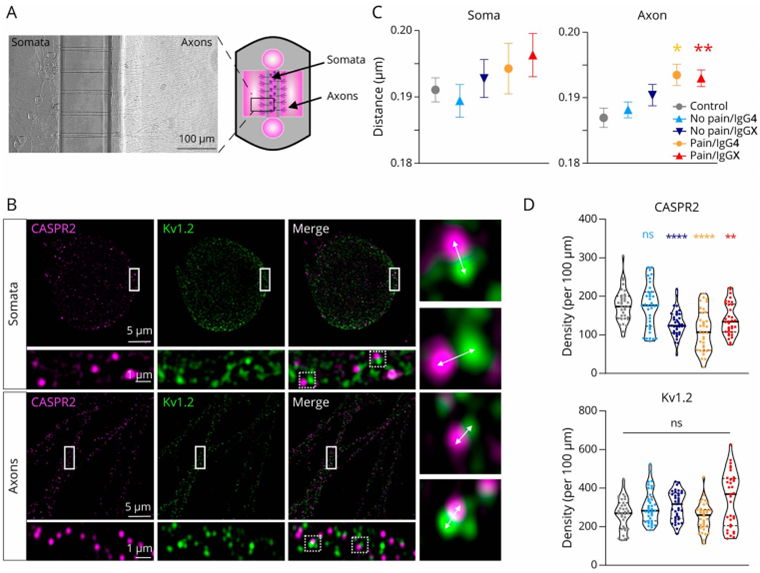
图2 CASPR2 抗体影响CASPR2的表达及VGKC复合物的结构完整性
神经 “过度兴奋”:疼痛信号失控的根源
钾通道功能受损会带来什么后果?钙成像实验给出了答案:DRG神经元的兴奋性显著升高。在正常情况下,神经元就像一个有规律的“脉冲发生器”,而CASPR2处理后,神经元变得异常活跃,钙信号的频率、幅度和强度都大幅增加,就像电路短路后不断发出错误信号(图3)。
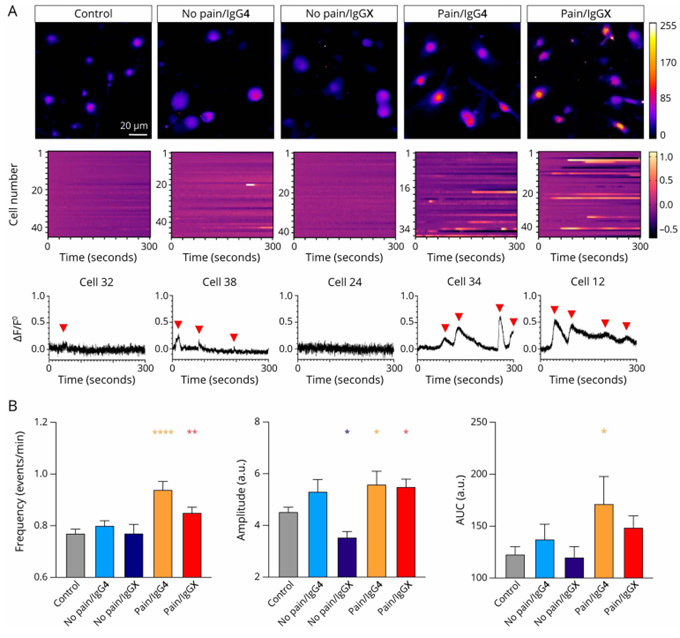
图3 CASPR2自身抗体影响背根神经节(DRGs)的自发钙活性
功能失灵:钾通道“罢工”导致神经元“过度兴奋”
全细胞膜片钳记录显示,所有CASPR2抗体组的钾通道电流幅度均显著降低,其中单独IgG4抗体组的影响最为突出。而当用健康血清替换患者抗体后,钾通道功能可恢复正常(图4)。这表明CASPR2抗体的作用并非永久性损伤,而是通过“结构性阻塞”干扰了VGKC复合体的相互作用。

图4 CASPR2自身抗体减引起钾离子通道电流的减少
临床启示:精准靶向 IgG4 或成治疗新方向
这项研究揭示了CASPR2抗体介导神经性疼痛的关键机制:IgG4具有独特的结构特征(无法交联蛋白、不激活补体),通过作用于CASPR2导致VGKC 复合体解离,而非单纯降低CASPR2表达(图5)。而这种现象由有别于神经损伤,在清除IgG4后是可逆的,因此IgG4靶向治疗具有较大研究前景。
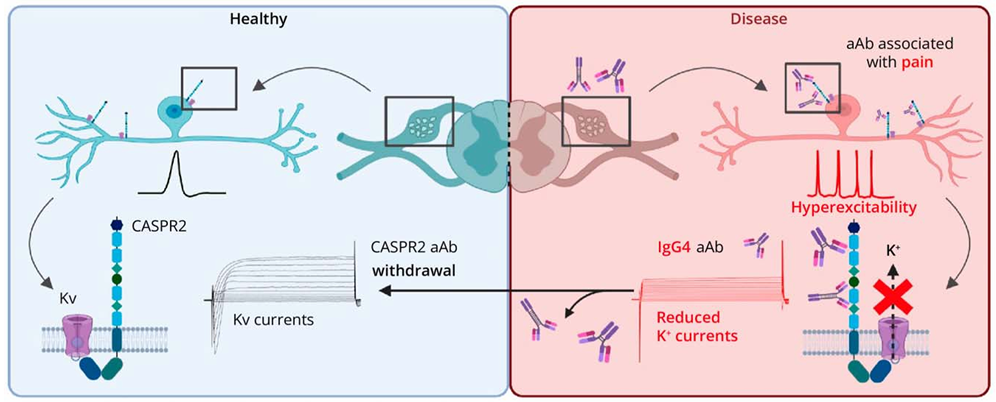
图5 CASPR2 自身抗体引起疼痛的机制
对于临床实践,这意味着未来可能通过检测抗体亚类来预测疼痛风险,甚至开发针对IgG4的靶向疗法。例如,通过调节IgG4的Fab臂交换特性,或阻断其与CASPR2的结合位点,有望从源头缓解神经元过度兴奋。
此外,尽管此研究取得了重要突破,但仍有许多疑问未被解释:
为何部分患者仅有IgG4抗体却无疼痛?是否存在其他辅助因子?
除了钾通道,是否还有其他离子通道或信号通路参与疼痛形成?
不同IgG亚类的组合(如 IgG4+IgG2)是否会影响疾病严重程度?
神经性疼痛的机制极其复杂,而CASPR2抗体及其亚类的发现,拓展了人们对之认识的视野。随着抗体研究技术的发展和相关机制研究的深入,我们有望找到更精准的治疗方式,为饱受神经性疼痛困扰的患者带来福音。
参考文献:
[1]Habib M, Wiessler AL, Fischer P, et al. Neuropathic Pain and Distinct CASPR2 Autoantibody IgG Subclasses Drive Neuronal Hyperexcitability. Neurol Neuroimmunol Neuroinflamm. 2025;12(4):e200423. doi:10.1212/NXI.0000000000200423